Magiczna trójca nutraceutyków: kolagen, glukozamina i chondroityna

Starzenie się jest naturalnym procesem, w którym zachodzą zmiany w tkance łącznej i jej podstawowych białkach: kolagenie i elastynie, co, między innymi, prowadzi do postępującego obniżenia sprawności poszczególnych funkcji fizjologicznych (Robert i wsp., 2008). Proces ten wpływa negatywnie na tkankę łączną w różnych strukturach biologicznych, np. w skórze, czy w chrząstce stawowej. W skórze starzenie powoduje zmniejszenie liczby włókien kolagenu i elastyny, co ostatecznie prowadzi do zwiotczenia skóry i powstania drobnych i głębokich zmarszczek (Tzaphlidou, 2004). Z wiekiem zmniejsza się również ilość glikozaminoglikanów (GAG) w naskórku i skórze właściwej, takich jak glukozamina, chondroityna i kwas hialuronowy, co prowadzi do zmniejszenia zdolności do zatrzymywania wody i w konsekwencji do zwiększenia suchości skóry (Lee i wsp., 2016).

Starzenie się chrząstki stawowej można powiązać bezpośrednio ze zmniejszeniem zawartości proteoglikanów, co skutkuje zmiękczeniem powierzchni chrząstki i stopniową utratą właściwości biomechanicznych macierzy zewnątrzkomórkowej (ang. extracellular matrix, ECM) (Roughley, 2001). Niektóre dowody naukowe sugerują również, że liczba chondrocytów w ECM zmniejsza się wraz z wiekiem, co określono terminem „senescencji chondrocytów” (tzn. starzenia biologicznego komórek tkanki chrzęstnej – chondrocytów) (Loeser, 2009). Starzejąca się chrząstka stawowa jest osłabiona, narażona na deformacje podczas ruchów w stawie i bardziej podatna na rozwój zmian osteoartretycznych. Choroba zwyrodnieniowa stawów (osteoartroza, OA) jest to wolno postępująca, degeneracyjno-zapalna choroba o złożonej etiologii, która rozwija się w wyniku skumulowanego działania kilku czynników biologicznych i mechanicznych (Radin, 2020). Rozwój i szybsza progresja OA może być związana z urazami w obrębie stawu, nieprawidłowościami strukturalnymi stawu, powtarzalną i nadmierną eksploatacją stawu (np. biodrowego czy kolanowego) oraz osłabieniem mięśni szkieletowych (Grigorjevich i wsp., 2020; Matyushkin i wsp., 2022; Sono i wsp., 2019). Ostrożne szacunki częstości występowania OA na podstawie samych objawów mogą dotyczyć zaledwie 2–3% populacji, natomiast uwzględnienie objawów w połączeniu z wynikami badań radiograficznych, samych wyników badań radiograficznych lub samodzielnej diagnozy, może zwiększyć szacunki częstości występowania do ponad 30% u pacjentów w wieku powyżej 60 lat (Helmick i wsp., 2008; Lawrence i wsp., 2008).

W kontekście coraz gorszych statystyk zachorowań na różnego typu artropatie (ang. arthropathy), do których włącza się niejednorodną grupę chorób zapalnych i niezapalnych dotykających staw/-y, pojawia się pilna potrzeba wdrożenia efektywnych środków niefarmakologicznych i naturalnych metod poprawiających stan kliniczny i ogólną jakość życia osób cierpiących na artropatie. W przypadku różnego typu artropatii jedną z dostępnych opcji jest wykorzystanie wysokiej jakości produktów nutraceutycznych, których efektywność terapeutyczna została zweryfikowana zgodnie z podejściem evidence-based medicine (EBM), czyli medycyny opartej na faktach lub dowodach naukowych.
Spis treści
Nutraceutyki
Współcześnie w celach profilaktycznych, ale i w terapii wielu jednostek chorobowych, stosuje się różne strategie bazujące na określonych nutraceutykach, czyli specyficznych substancjach pochodzenia naturalnego, łączących w sobie wartości żywieniowe i cechy środków farmaceutycznych. Termin nutraceutyk powstał z połączenia angielskich słów „nutrition” (odżywianie) i „pharmaceutical” (farmaceutyczny).

Nutraceutyki są więc substancjami aktywnymi biologicznie o potencjale wzmacniającym, osłabiającym lub modyfikującym funkcje fizjologiczne i metaboliczne organizmu. Zalicza się do nich żywność funkcjonalną, suplementy diety oraz pre- i probiotyki, które zapewniają korzyści zdrowotne, ale co istotne, są zasadniczo pozbawione działań niepożądanych (efektów ubocznych). W ostatnich latach rekomendowane jest doustne przyjmowanie nutraceutyków, np. u pacjentów z chorobami układu kostno-stawowego, w celu wspomagania fizjologicznego obrotu tkanki łącznej w chrząstkach stawowych, ścięgnach i więzadłach, aby ograniczać procesy zapalne i degeneracyjne tych struktur (Oppedisano i wsp., 2021). Wyniki wielu badań naukowych wykazały, że przebadane klinicznie doustne suplementy diety w postaci hydrolizowanego kolagenu (typu I), siarczanu glukozaminy i chondroityny (GlcN-CS), kwasu L-askorbinowego (witaminy C), alfa-keto-glutaranu L-argininy (AAKG), kurkuminy, kwasów bosweliowych (Boswellia serrata), metylosulfonylometanu (siarka organiczna, MSM), S-adenozylometioniny (SAMe), bromelainy czy różnych czynników wzrostu, dedykowane pacjentom z OA i bólami stawów, zwiększają stężenie tych związków w tkankach łącznych i mogą pomóc w zachowaniu, a nawet naprawie uszkodzonych struktur (Henrotin i wsp., 2011; Ravalli i wsp., 2018). Skuteczność tych środków potwierdzają liczne opinie dietetyków, reumatologów, ortopedów i lekarzy rodzinnych.
Suplementy na bazie tych związków charakteryzują się stosunkowo powolnym działaniem w okresie pierwszych 6 do 8 tygodni oraz przeniesieniem efektu na okres do 2 miesięcy po odstawieniu, czyli zaprzestaniu suplementacji (Fajardo i Di Cesare, 2005).
Należy zaznaczyć, że opisywane suplementy diety nie są poddawane rygorystycznym kontrolom i procesom licencjonowania tak jak leki; nawet jeśli niektóre z tych produktów otrzymały pozwolenia na komercjalizację w formie leków. Jednak badania randomizowane kontrolowane za pomocą placebo dostarczają niejednoznacznych dowodów dotyczących zakresu potencjalnych działań modyfikujących proces chorobowy oraz klinicznej skuteczności tych środków. Rozpatrzymy dane na temat tzw. „magicznej trójcy” nutraceutyków, tj. hydrolizatu kolagenu, siarczanu glukozaminy i siarczanu chondroityny (GlcN-CS).
Hydrolizowany kolagen
U kręgowców (w tym u człowieka) 25–35% całkowitej masy białka stanowi kolagen. Do tej pory zidentyfikowano 29 typów kolagenu, które sklasyfikowano według ich struktury i funkcji (Lin i wsp., 2019). W organizmie człowieka białko to występuje w skórze, włosach, ścięgnach, kościach, chrząstkach, więzadłach, skórze, mięśniach oraz innych tkankach (Gisbert, i wsp., 2021). Typy I, II i III odpowiadają za 80–90% całego kolagenu występującego w organizmie człowieka, a typ I występuje najobficiej w skórze (80%). Kolagen typu III stanowi 15% wszystkich typów kolagenu. W chrząstce stawowej w tworzeniu macierzy zewnątrzkomórkowej dominuje kolagen typu II (90–95%), natomiast inne typy kolagenu (I, IV, V, VI, IX i XI) przyczyniają się do tworzenia i stabilizacji sieci fibryli kolagenu typu II (Kisling i wsp., 2019).

Hydrolizowany kolagen składa się z niewielkich peptydów o niskiej masie cząsteczkowej (0,3–8 kDa, kilodaltonów), wytwarzanych z natywnego kolagenu (naturalny, niedenaturowany, biologicznie aktywny zestaw peptydów kolagenowych, łatwo przyswajalnych przez organizm), który występuje w kościach, skórze i tkance łącznej zwierząt (tj. bydła, świń, ptactwa i ryb).
Ze względu na niską masę cząsteczkową (molekularną), istnieje kilka zalet stosowania hydrolizowanego kolagenu w stosunku do kolagenu natywnego:
- jest wysoce strawny;
- jest łatwo wchłaniany (absorbowany);
- jest efektywnie rozprowadzany (dystrybuowany) w organizmie człowieka.

Ponadto hydrolizaty kolagenu o niskiej masie cząsteczkowej (jak produkt firmy Collibre), mają wyższą strawność, biodostępność oraz wykazują większą aktywność biologiczną (biodostępność) niż żelatyna (Hong i wsp., 2019), co sprzyja przygotowywaniu hydrolizatu kolagenu z różnych produktów ubocznych pochodzenia zwierzęcego. Największe korzystne działanie hydrolizatu kolagenu, czy inaczej tzw. peptydów kolagenowych (ang. collagen peptides, CPs), dotyczy populacji ludzkich z zaawansowanymi procesami degradacji kolagenu w różnych tkankach (choroby zwyrodnieniowe stawów, tendinopatie, etc.) lub o zwiększonym ryzyku rozwoju tego typu schorzeń, takich jak utrata tkanki kostnej i chrząstek stawowych wynikająca z procesu starzenia, ale i z nadmiernej aktywności fizycznej (ekstremalne formy wysiłku fizycznego), nieprawidłowej diety, nadwagi/otyłości, zaburzeń hormonalnych, urazów, oparzeń, agresywnej terapii antynowotworowej, wszczepionych implantów skórnych i stomatologicznych etc. (Juher i Pérez, 2015). W skrócie, mechanizm ich działania polega głównie na zahamowaniu lub zwiększeniu roli mediatorów biologicznych w celu zachowania integralności strukturalnej różnych tkanek (Vista i Lau, 2011). Z tych względów hydrolizat kolagenu/peptydy kolagenowe, można uznać za produkt nutraceutyczny, gdyż oprócz funkcji odżywczej (dostarczanie aminokwasów kolagenotwórczych: głównie glicyny, proliny i hydroksyproliny), korzystnie wpływa na liczne mechanizmy fizjologiczne i działa protekcyjnie (ochronnie) w zakresie różnych jednostek chorobowych. Na przykład, w jednym z badań wykazano korzystne efekty doustnej suplementacji hydrolizowanego kolagenu typu I w gojeniu ścięgien, obniżając stan zapalny i ból spowodowany tendinopatią – patologicznymi zmianami degeneracyjnymi ścięgien, a dokładnie ich włókien (Gumina i wsp., 2012).
Istotne jest, aby podkreślić, że zarówno Światowa Organizacja Zdrowia (WHO), jak i Komisja Europejska (Dyrekcja Generalna ds. Ochrony Zdrowia i Konsumentów) potwierdziły, że hydrolizowany kolagen jest bezpieczny.
Gwiazdy glikozoaminoglikanów (glukozamina i chondroityna)
Glikozaminoglikany (ang. glycosaminoglycans, GAG) są to organiczne związki chemiczne należące do rodziny heteropolisacharydów, występujące w ludzkiej chrząstce, kości, rogówce, skórze oraz ścianie tętnic. Glikozaminoglikany stanowią de facto konstrukcję nośną dla kolagenu.

Glukozamina (GlcN) to aminomonosacharyd, inaczej monomer chitozanu, który jest składnikiem prawie wszystkich ludzkich tkanek, w tym chrząstki stawowej (Deal i Moskowitz, 1999). Jest wytwarzana w organizmie poprzez dodanie grupy aminowej do glukozy i stanowi element niezbędny do syntezy glikozaminoglikanów. Preparaty GlcN są pozyskiwane z chityny (z muszli skorupiaków) poprzez hydrolizę kwasową (i dlatego pacjenci uczuleni na skorupiaki powinni unikać stosowania glukozaminy) lub syntetyzowane chemicznie. Istnieją trzy formy GlcN powszechnie dostępne na rynku:
- chlorowodorek glukozaminy (z muszli krabów),
- siarczan glukozaminy (ze skorupek krewetek),
- siarczan glukozaminy (chemicznie syntetyzowany).
Wielokrotnie podejmowano badania kliniczne testujące ten produkt nutraceutyczny u ludzi i zaobserwowano liczne pozytywne efekty, jak np. wspomaganie utrzymania wytrzymałości, elastyczności oraz regeneracji tkanek chrzęstnych, funkcje modulacyjne w symptomach OA poprzez działanie przeciwzapalne i chondroprotekcyjne, czy zapobieganie degradacji przy jednoczesnym podtrzymywaniu syntezy kolagenu typu II w chrząstce stawowej u sportowców trenujących dyscypliny wytrzymałościowe (Nagaoka i wsp., 2019). Wykazano również, że regularna suplementacja GlcN wiązała się z niższą śmiertelnością z powodu wszystkich przyczyn, w tym nowotworów złośliwych, chorób układu krążenia, chorób układu oddechowego i pokarmowego (Li i wsp., 2020).
W podsumowaniu badań nad glukozaminą, uwzględniając wiele przeglądów systematycznych i metaanaliz, należy stwierdzić, że glukozamina zapobiega osteoartrozie i utrzymuje zdrowie stawów poprzez zmniejszenie stanu zapalnego, poprawę potencjału redoks (status oksydacyjno-redukcyjny, reakcje utleniania–redukcji) oraz indukowanie autofagii w stawach (Veronese i wsp., 2020; Yang i wsp., 2021). Dalsze badania są uzasadnione w celu określenia synergistycznego wpływu glukozaminy z innymi środkami przeciwzapalnymi i/lub antyoksydacyjnymi na zdrowie stawów u ludzi (Al-Saadi i wsp., 2019).
Chondroityna (CS) jest fundamentalnie ważnym składnikiem chrząstki stawowej. Źródła chondroityny stosowanej w suplementach diety obejmują tchawicę wołową, produkty uboczne z wieprzowiny, chrząstkę rekina i przegrodę wieloryba (Wei i wsp., 2020). Mechanizmy działania chondroityny przyjmowanej doustnie w czystej formie (o masie cząsteczkowej ok. 16,9 kDa) dotyczą przywrócenia właściwości fizykochemicznych macierzy zewnątrzkomórkowej chrząstki oraz zapobiegania jej dalszej degradacji (Pal i Saha, 2019). Wskazuje się również pozytywne efekty w zakresie uzupełnienia niedoboru w diecie aminokwasów zawierających siarkę (tzw. aminokwasów siarkowych), które są niezbędnym budulcem dla cząsteczek macierzy zewnątrzkomórkowej chrząstki (Cordoba, 2003). W toku procesu starzenia, chrząstka stawowa stopniowo traci macierz, wodę i komórki. Już dawno stwierdzono, że stężenie chondroityny (w postaci siarczanu) w stawach kolanowych osób z osteoartrozą jest odwrotnie proporcjonalne do stopnia zaawansowania choroby (Bollet i Nance, 1966; Matthews, 1953).
Zarówno siarczan chondroityny, jak i siarczan glukozaminy, są naturalnymi związkami uznawanymi za wolno działające leki w chorobie zwyrodnieniowej stawów kolanowych, biodrowych i innych (ang. Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA) (Honvo i wsp., 2019). Przy czym chondroityna należy do kategorii związków modyfikujących objawy, tzn. wykazuje główny wpływ na redukcję bólu i poprawę funkcji stawu. Natomiast glukozamina jest zaliczana do kategorii związków modyfikujących strukturę, bo np. hamuje proces zwężania szpary stawowej oceniane na podstawie radiografii. W innym ujęciu, glukozamina i chondroityna są definiowane jako środki przeciwzapalne stawów (ang. anti-osteoarthritis agents). Jedną z głównych proponowanych przewag tych związków (w formie leku lub wysokiej jakości suplementu diety) nad tradycyjnymi terapiami medycznymi jest ich profil bezpieczeństwa. Dotychczas, jedynie wysokooczyszczone preparaty farmaceutyczne wykazały skuteczność kliniczną i są rekomendowane jako bezpieczna terapia w początkowym stanie choroby zwyrodnieniowej stawów (Bruyere et al., 2018).

Siarczany chondroityny i glukozaminy występują w różnych formach (hydrożele, iniekcje, suplementy diety) i stanowią ważne alternatywy terapeutyczne, ponieważ są wszechobecne w ludzkim organizmie, w tym również będąc podstawowymi składnikami chrząstki stawowej. W rzeczywistości GlcN i CS (głównie pochodzenia wołowego) są dostępne jako leki oraz suplementy diety zapobiegające degradacji chrząstki stawowej poprzez zwiększenie ich stężenia w stawie (wykazują powinowactwo do tkanki stawowej): pomagają one zachować, a nawet naprawić uszkodzoną powierzchnię stawową w OA (Reginster i wsp., 2021). Według jednych z ostatnich badań siarczan chondroityny modyfikowany peptydami posiada najwyższy współczynnik przepuszczalności do płynu stawowego i do chrząstki stawowej oraz zmniejsza współczynnik tarcia na powierzchni chrząstki stawowej (Twitchell i wsp., 2020).
Efekt synergii biologicznej (1 + 1 nie równa się 2, lecz czasem 4)
Związki chemiczne, w tym składniki odżywcze, które spełniają w organizmie różnorodne funkcje, nigdy nie działają w sposób wyizolowany. W cyklu złożonych procesów metabolicznych wchodzą ze sobą w interakcje i na zasadzie mechanizmu synergii biologicznej, tzn. większego efektu ich łącznej interakcji niż efektu ich pojedynczego działania, wykazują różne efekty prozdrowotne (włączając w to efekty wzmacniające strukturę i funkcje tkanki chrzęstnej). Badania in vitro (łac. „w szkle”) i in vivo (łac. „na żywym”) potwierdzają istnienie synergicznego związku między glukozaminą i chondroityną (obu w postaci siarczanu), związanego z regulacją syntezy macierzy proteoglikanów i obniżeniem aktywności metaloproteinaz, a więc „złych” enzymów odpowiedzialnych za degradację kolagenu (Clegg i wsp., 2006; Collier i Ghosh, 1989; Lippiello, 2003; Orth i wsp., 2002), co sugeruje efekt „chondroprotekcyjny”.

Schemat graficzny ilustrujący efekty chondroprotekcyjne (ochronne na chrząstkę stawową) wywierane przez nutraceutyki w postaci hydrolizatu kolagenu (peptydów kolagenowych, CP), siarczanu glukozaminy (GlcN) oraz chondroityny (CS) w stawie kolanowym.
Połączenie GlcN i CS skutecznie stymuluje neosyntezę kolagenu w hodowlach komórkowych tkanki więzadeł, ścięgien i tkanki chrzęstnej (Lippiello, 2006). W badaniach przedklinicznych, fizjologiczne poziomy GlcN + CS zwiększały neosyntezę kolagenu o 69% w komórkach więzadła i o 22% w tenocytach (Lippiello, 2007). Wyjaśnię, że tenocyty to komórki podobne do fibroblastów, które stanowią podstawowy składnik komórkowy tkanki ścięgna i są ułożone między włóknami kolagenu. W innych badaniach O’Grady i wsp. (2000) również wykazali zwiększoną ekspresję genów odpowiedzialnych za syntezę kolagenu w przypadku obu środków stosowanych w sposób wyizolowany, jak również w przypadku kombinacji tych nutraceutyków/leków. Oczywiście GlcN oraz CS łączy się również z hydrolizatem kolagenu, który jest zbiorem funkcjonalnych peptydów (głównie di- oraz tripeptydów). Na przykład Scarpellini i wsp. (2008) podjęli badania testujące potencjalną zdolność częściowo zhydrolizowanego kolagenu typu II, w połączeniu z glukozaminą, w zmniejszaniu uszkodzeń i zatrzymania progresji OA. Jak wiemy, różne białka kolagenowe nadają kościom elastyczność, pomagając im wytrzymywać napięcie fizyczne, natomiast kolagen typu II pomaga również promować syntezę nowej chrząstki i zmniejsza uszkodzenia oksydacyjne stawów. W opisywanym badaniu synergiczna mieszanka naturalnych związków aktywnych biologicznie (kolagen + glukozamina), działała efektywnie w zakresie zmniejszenia uszkodzeń zarówno stawowych, jak i kostnych. Te pozytywne efekty wynikały prawdopodobnie z zakłócenia procesów katabolicznych w chrząstce stawowej, wspomagania syntezy nowej chrząstki i zmniejszenia uszkodzeń oksydacyjnych stawu.
Z ogólnoświatowych danych wynika, że duża liczba pacjentów cierpiących na OA stosuje albo preparat z samą GlcN, lub preparat z CS, w celu złagodzenia symptomów związanych z chorobą zwyrodnieniową. Jednak coraz częściej i relatywnie efektywnie wykorzystywana jest terapia skojarzona GlcN plus CS (zazwyczaj podawane dawki w badaniach klinicznych zawierały się w przedziale 500 do 1200 mg), ale nie jest do końca jasne, czy te dwa suplementy wykazują efekt synergiczny, czy tylko addytywny.
Jakie są aktualne rekomendacje dotyczące dawkowania u osób z osteoartrozą?
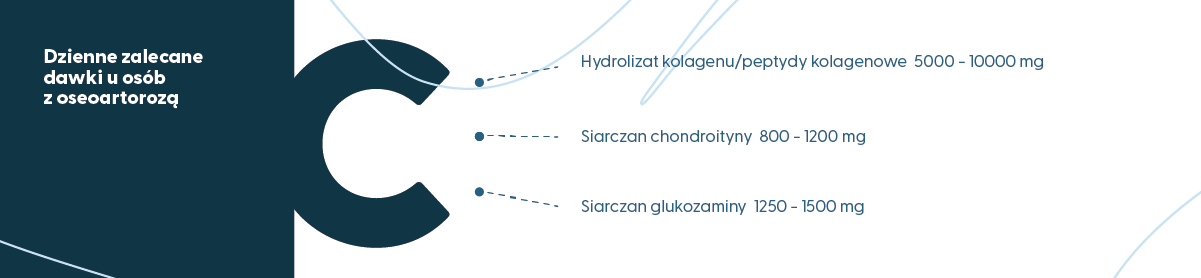
Dzienne zalecane dawki wynoszą:
- Hydrolizat kolagenu/peptydy kolagenowe: od 5000 do 10000 mg na dobę;
- Siarczan chondroityny (CS): od 800 do 1200 mg na dobę;
- Siarczan glukozaminy (GlcN): od 1250 do 1500 mg na dobę.
Ciekawostka suplementacyjna: W celu modulowania patogenezy OA rekomenduje się również pacjentom stosowanie probiotykoterapii z wykorzystaniem bakterii Lactobacillus casei (L. casei) w połączeniu z glukozaminą i kolagenem typu II (So i wsp., 2008).
Wygaszanie bólu (kolagen versus glukozamina)
Przeprowadzono wiele badań przedklinicznych i klinicznych dotyczących leczenia bólu stawów za pomocą kolagenu podawanego doustnie, w szczególności kolagenu typu II, który jest głównym składnikiem chrząstki stawowej, ale i głównym autoantygenem u ludzi z reumatoidalnym zapaleniem stawów (RZS) (Liang i wsp., 2019). W jednym z badań czeskich naukowców (Trč i Bohmová, 2011) wykazano, że siła działania analgetycznego (przeciwbólowego) kolagenu hydrolizowanego enzymatycznie w dawce 10 g była większa niż siarczanu glukozaminy w dawce 1,5 g u pacjentów z osteoartrozą stawu kolanowego w okresie 90-dniowej interwencji. Istotne obniżenie wskaźników WOMAC i VAS (skale bólu) zaobserwowano u 80,8% badanej populacji (p < 0,01), która otrzymywała doustnie suplement z hydrolizowanym kolagenem. Natomiast tylko u 46,6% badanych osób w grupie siarczanu glukozaminy wykazano redukcję symptomów bólowych. Poza tym, hydrolizat kolagenu był ogólnie dobrze tolerowany. A więc jakbyśmy chcieli porównać kolagen z glukozaminą w zakresie ich oddziaływania przeciwbólowego („mocy przeciwbólowej”), to z tej walki zwycięsko wychodzi kolagen (przynajmniej na podstawie w/w badania).
Podsumowanie
Patofizjologia osteoartrozy jest bardziej złożonym procesem niż tylko „zużywanie się” chrząstki stawowej. Nie jest to choroba pojedynczej tkanki, ale choroba, która obejmuje cały staw. Istnieje kilka komplementarnych i alternatywnych terapii związanych z metabolizmem i naprawą tkanki łącznej. Do tej pory opracowano wiele środków odżywczych i farmaceutycznych (nutraceutycznych), które są stosowane również w połączeniu (w ramach terapii skojarzonej), aby zwiększyć skuteczność w opóźnianiu postępu degeneracyjnych zmian strukturalnych w chrząstce stawowej osób cierpiących na choroby zwyrodnieniowe stawów (Oppedisano i wsp., 2021). Na podstawie aktualnych dowodów naukowych należy stwierdzić, że odpowiednie stosowanie kombinacji trzech nutraceutyków – hydrolizatu kolagenu, siarczanu glukozaminy oraz siarczanu chondroityny, jest zasadne w kontekście wczesnej profilaktyki chorób degeneracyjnych. Jednocześnie, tego typu kombinacja, jako terapia skojarzona, stanowi dodatkowe nieinwazyjne narzędzie wspierające proces terapeutyczny. Kliniczne znaczenie tych informacji odnosi się m. in. do dokumentacji medycznej pokazującej, że pacjenci z urazami łąkotek i więzadeł stawu kolanowego mają wysoką częstość rozwoju zmian zwyrodnieniowych, wyrażonych zmianami radiologicznymi, w okresie 10–20 lat (Messner, 1998). W związku z tym, że kolagen jest głównym składnikiem tkanki łącznej, naukowcy sugerują, że zwiększenie jego syntezy przez połączenie GlcN i CS może przyspieszyć naprawę tkanek okołostawowych i zmniejszyć prawdopodobieństwo rozwoju osteoartrozy i chorób pokrewnych.
Piśmiennictwo
[1] Al-Saadi, H.M., Pang, K.L., Ima-Nirwana, S., Chin, K.Y. (2019). Multifaceted protective role of glucosamine against osteoarthritis: review of its molecular mechanisms. Sci Pharm, 87(4), 34.
[2] Bollet, A.J., Nance, J.L. (1966). Biochemical findings in normal and osteoarthritic articular cartilage. II. Chondroitin sulfate concentration and chain length, water, and ash content. J Clin Investig, 45(7), 1170-1177.
[3] Bruyère, O., Cooper, C., Al-Daghri, N.M., Dennison, E.M., Rizzoli, R., Reginster, J.Y. (2018). Inappropriate claims from non-equivalent medications in osteoarthritis: a position paper endorsed by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Aging Clin Exp Res, 30, 111-117.
[4] Clegg, D.O., Reda, D.J., Harris, C.L., Klein, M.A., O’Dell, J.R., Hooper, M.A., … Williams, H.J. (2006). Glucosamine, chondroitin sulfate and the two in combination for painful knee osteoarthritis. N Engl J Med, 354, 795-808.
[5] Collier, S., Ghosh, P. (1989). Evaluation of the effect of antiarthritic drugs on the secretion of proteoglycans by lapine chondrocytes using a novel assay procedure. Ann Rheum Dis, 48(5), 372-381.
[6] Deal, C.L., Moskowitz, R.W. (1999). Nutraceuticals as therapeutic agents in osteoarthritis: the role of glucosamine, chondroitin sulfate, and collagen hydrolysate. Rheum Dis Clin North Am, 25(2), 379-395.
[7] Fajardo, M., Di Cesare, P.E. (2005). Disease-modifying therapies for osteoarthritis: current status. Drugs Aging, 22, 141-161.
[8] Gisbert, V.G., Benaglia, S., Uhlig, M.R., Proksch, R., Garcia, R. (2021). High-speed nanomechanical mapping of the early stages of collagen growth by bimodal force microscopy. ACS nano, 15(1), 1850-1857.
[9] Grigorjevich, E.G., Givievnа, T.T., Aleksandrovich, K.P., Georgievna, M.R., Iraklievna, B.M., Shalvovich, B.T., … Sergeevna, T.Е. (2020). Some aspects of osteoarthrosis spread prevention and treatment. International scientific review, (LXXI), 97-99.
[10] Gumina, S., Passaretti, D., Gurzi, M.D., Candela, V. (2012). Arginine L-alpha-ketoglutarate, methylsulfonylmethane, hydrolyzed type I collagen and bromelain in rotator cuff tear repair: a prospective randomized study. Curr Med Res Opin, 28(11), 1767-1774.
[11] Helmick, C.G., Felson, D.T., Lawrence, R.C., Gabriel, S., Hirsch, R., Kwoh, C.K., … National Arthritis Data Workgroup. (2008). Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: part I. Arthritis Rheum, 58(1), 15-25.
[12] Henrotin, Y., Lambert, C., Couchourel, D., Ripoll, C., Chiotelli, E. (2011). Nutraceuticals: do they represent a new era in the management of osteoarthritis?–a narrative review from the lessons taken with five products. Osteoarthr. Cartil, 19(1), 1-21.
[13] Hong, H., Fan, H., Chalamaiah, M., Wu, J. (2019). Preparation of low-molecular-weight, collagen hydrolysates (peptides): Current progress, challenges, and future perspectives. Food Chem, 301, 125222.
[14] Honvo, G., Reginster, J.Y., Rabenda, V., Geerinck, A., Mkinsi, O., Charles, A., … Bruyère, O. (2019). Safety of symptomatic slow-acting drugs for osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging, 36, 65-99.
[15] Juher, T.F., Pérez, E.B. (2015). An overview of the beneficial effects of hydrolysed collagen intake on joint and bone health and on skin ageing. Nutr Hosp, 32, 62-66.
[16] Kisling, A., Lust, R. M., Katwa, L.C. (2019). What is the role of peptide fragments of collagen I and IV in health and disease?. Life Sci, 228, 30-34.
[17] Lawrence, R.C., Felson, D.T., Helmick, C.G., Arnold, L.M., Choi, H., Deyo, R.A., … National Arthritis Data Workgroup. (2008). Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: part II. Arthritis Rheum, 58(1), 26-35.
[18] Lee, D.H., Oh, J.H., Chung, J.H. (2016). Glycosaminoglycan and proteoglycan in skin aging. J Dermatol Sci, 83(3), 174-181.
[19] Li, Z.H., Gao, X., Chung, V.C., Zhong, W.F., Fu, Q., Lv, Y.B., … Mao, C. (2020). Associations of regular glucosamine use with all-cause and cause-specific mortality: a large prospective cohort study. Ann Rheum Dis, 79(6), 829-836.
[20] Liang, B., Ge, C., Lönnblom, E., Lin, X., Feng, H., Xiao, L., … Holmdahl, R. (2019). The autoantibody response to cyclic citrullinated collagen type II peptides in rheumatoid arthritis. Rheumatology, 58(9), 1623-1633.
[21] Lin, K., Zhang, D., Macedo, M. H., Cui, W., Sarmento, B., Shen, G. (2019). Advanced collagen‐based biomaterials for regenerative biomedicine. Adv Funct Mater, 29(3), 1804943.
[22] Lin, Y.C., Liang, Y.C., Sheu, M.T., Lin, Y.C., Hsieh, M.S., Chen, T.F., Chen, C.H. (2008). Chondroprotective effects of glucosamine involving the p38 MAPK and Akt signaling pathways. Rheumatol Int, 28, 1009-1016.
[23] Lippiello, L. (2003). Glucosamine and chondroitin sulfate: biological response modifiers of chondrocytes under simulated conditions of joint stress. Osteoarthr Cartil, 11, 335-342.
[24] Lippiello, L. (2006). Collagen Synthesis in Tenocytes, Ligament Cells and Chondrocytes Exposed to a Combination of Glucosamine HCl and Chondroitin Sulfate. eCAM, 4(2), 219-224.
[25] Lippiello, L. (2007). Collagen Synthesis in tenocytes, ligament cells and chondrocytes exposed to a combination of Glucosamine HCl and chondroitin sulfate. eCAM, 4(2), 219-224.
[26] Loeser, R.F. (2009). Aging and osteoarthritis: the role of chondrocyte senescence and aging changes in the cartilage matrix. Osteoarthr Cartil, 17(8), 971-979.
[27] Matthews, B.F. (1953). Composition of articular cartilage in osteoarthritis. British Medical Journal, 2(4837), 660-661.
[28] Matyushkin, A.I., Ivanova, E.A. Voronina, T.A. (2022). New Directions in the Development of Pharmacotherapy for Osteoarthrosis Based on Modern Concepts of the Disease Pathogenesis (A Review). Pharm Chem J, 55(12), 1282-1287.
[29] Messner, K. (1998). Current advances in sports-related cartilage research. Meniscus and ligament injuries are associated with increased risk of knee joint arthrosis. Lakartidningen, 95, 4611-4612.
[30] Nagaoka, I., Tsuruta, A., Yoshimura, M. (2019). Chondroprotective action of glucosamine, a chitosan monomer, on the joint health of athletes. Int J Biol Macromol, 132, 795-800.
[31] O’Grady C, Grande D, Marwin SE. Chondroprotection and gene expression effects of nutritional supplements on articular cartilage. Osteoarthr Cartil 2000; 8(Suppl B): S34–35.
[32] Oppedisano, F., Bulotta, R. M., Maiuolo, J., Gliozzi, M., Musolino, V., Carresi, C., … Mollace, V. (2021). The Role of Nutraceuticals in Osteoarthritis Prevention and Treatment: Focus on n-3 PUFAs. Oxid Med Cell Longev, 2021.
[33] Orth, M.W., Peters, T.L., Hawkins, J.N. (2002). Inhibition of articular cartilage degradation by glucosamine HCl and chondroitin sulfate. Equine Vet J, 34, 224-229.
[34] Pal, D., Saha, S. (2019). Chondroitin: a natural biomarker with immense biomedical applications. RSC advances, 9(48), 28061-28077.
[35] Radin, E.L. (2020). Osteoarthrosis. In: Mechanics of Human Joints (pp. 341-354). CRC Press.
[36] Ravalli, S., Szychlinska, M.A., Leonardi, R.M., Musumeci, G. (2018). Recently highlighted nutraceuticals for preventive management of osteoarthritis. World J Orthop, 9(11), 255.
[37] Reginster J.Y., Veronese N. Highly purified sulfate:a literature revive on clinical efficacy and pharmacoeconomic aspects in osteoarthritis treatment. Aging Clin Exp Res, 2021, 33, 37-47.
[38] Robert, L., Robert, A.M., Fülöp, T. (2008). Rapid increase in human life expectancy: will it soon be limited by the aging of elastin?. Biogerontology, 9, 119-133.
[39] Roughley, P. J. (2001). Articular cartilage and changes in arthritis: noncollagenous proteins and proteoglycans in the extracellular matrix of cartilage. Arthritis Res Ther, 3(6), 1-6.
[40] So, J.S., Lee, C.G., Kwon, H. K., Yi, H. J., Chae, C.S., Park, J.A., … Im, S.H. (2008). Lactobacillus casei potentiates induction of oral tolerance in experimental arthritis. Mol Immunol, 46(1), 172-180.
[41] Sono, T., Meyers, C.A., Miller, D., Ding, C., McCarthy, E.F., James, A.W. (2019). Overlapping features of rapidly progressive osteoarthrosis and Charcot arthropathy. J Orthop, 16(3), 260-264.
[42] Trč, T., Bohmová, J. (2011). Efficacy and tolerance of enzymatic hydrolysed collagen (EHC) vs. Glucosamine sulphate (GS) in the treatment of knee osteoarthritis (KOA). Int Orthop, 35(3), 341-348.
[43] Twitchell, C., Walimbe, T., Liu, J.C., Panitch, A. (2020). Peptide-modified chondroitin sulfate reduces coefficient of friction at articular cartilage surface. CRBIOT, 2, 16-21.
[44] Tzaphlidou, M. (2004). The role of collagen and elastin in aged skin: an image processing approach. Micron, 35(3), 173-177.
[45] Veronese, N., Demurtas, J., Smith, L., Reginster, J. Y., Bruyère, O., Beaudart, C., … on behalf on the European Geriatric Medicine Society Special Interest Groups in Systematic Reviews and Meta-Analyses and Arthritis. (2020). Glucosamine sulphate: an umbrella review of health outcomes. Ther Adv Musculoskelet Dis, 12, 1759720X20975927.
[46] Vista, E.S., Lau, C.S. (2011). What about supplements for osteoarthritis?: A critical and evidenced-based review. Int J Rheum Dis, 14(2), 152-158.
[47] Wei, M., Huang, L., Liu, Y., Jin, W., Yao, X., Rong, J., … Wang, Z. (2020). Strategy for isolation, preparation, and structural analysis of chondroitin sulfate oligosaccharides from natural sources. Anal Chem, 92(17), 11644-11653.
[48] Yang, W., Sun, C., He, S.Q., Chen, J.Y., Wang, Y., Zhuo, Q. (2021). The efficacy and safety of disease-modifying osteoarthritis drugs for knee and hip osteoarthritis—a systematic review and network meta-analysis. J Gen Intern Med, 36, 2085-2093.
Więcej artykułów

4 min. czytania
Najmocniejszy kolagen na stawy – który produkt Collibre wybrać?

9 min. czytania
Kolagen na skórę – jak działa i jaki wybrać?

6 min. czytania
































