Znaczenie kolagenu w profilaktyce i terapii choroby zwyrodnieniowej stawów (osteoartrozie)

Jedną z poważnych plag współczesnego świata są artropatie (ang. arthropathy) – duża grupa chorób (zapalnych i niezapalnych) dotyczących jednego lub większej liczby stawów, objawiająca się utratą poprawnej funkcjonalności stawu (Puigdellivol i wsp., 2019).
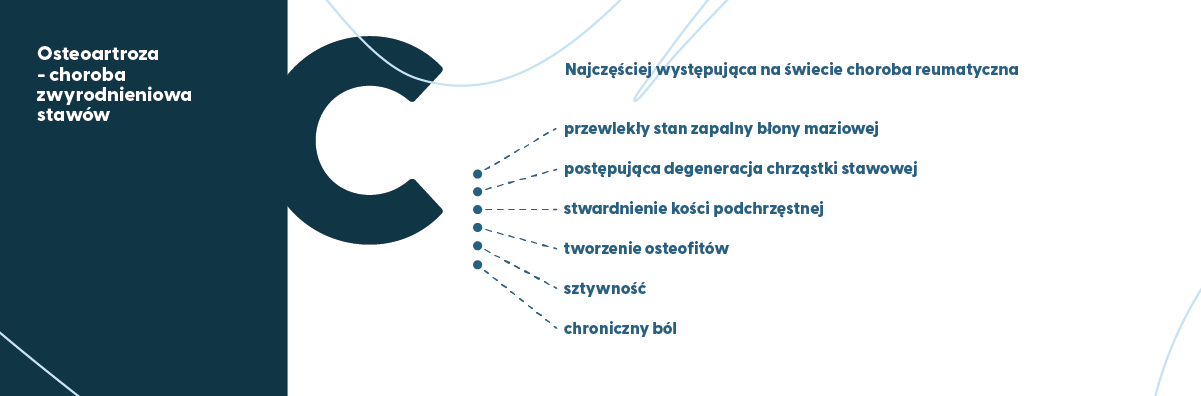
Do degeneracyjnych artropatii zalicza się choroba zwyrodnieniowa stawów, inaczej osteoartroza (ang. osteoarthritis, OA), która jest wieloczynnikową i najczęściej występującą z chronicznych chorób reumatycznych (jest ich ponad 200). Osteoartroza charakteryzuje się przewlekłym stanem zapalnym błony maziowej, postępującą degeneracją chrząstki stawowej, stwardnieniem kości podchrzęstnej i tworzeniem osteofitów, sztywnością i chronicznym bólem, co w konsekwencji prowadzi do postępującego pogorszenia mobilności ruchowej. (Allen i wsp., 2022; Hayami i wsp., 2006).
W 2013 roku opisano różne fenotypy OA: (1) związaną z otyłością, (2) indukowaną mechanicznie, i (3) związaną ze starzeniem (Conaghan, 2013). Jest to interesujące z klinicznego punktu widzenia, ale nie będziemy koncentrować się na szczegółach poszczególnych fenotypów. Rozpatrzymy OA ogólnie jako „kompleks chorobowy”.
Aktualnie OA stanowi istotny problem zdrowia publicznego w skali globalnej, ponieważ dotyczy ponad 300 milionów ludzi, i prawdopodobnie są to dane niedoszacowane (Kloppenburg i Berenbaum, 2020). Częstość występowania zapalenia stawów maziowych i przewlekłych objawów stawowych (jak chroniczny ból, sztywność po bezczynności, lokalne zapalenia różnego stopnia i ograniczony zakres ruchomości w stawach) zwiększa się wraz z wiekiem, dlatego na OA cierpią głównie osoby w wieku podeszłym, co istotnie ogranicza ich sprawność funkcjonalną (np. wchodzenie po schodach) (Sarzi-Puttini i wsp., 2005). W jednym z badań ryzyko wystąpienia OA wzrosło 10-krotnie w populacji osób między 30. a 60. rokiem życia, wzrastając jeszcze bardziej u osób po 65. roku życia (Oliveria i wsp., 1995). W krytycznych sytuacjach kliniczną manifestacją OA może być nawet… udar mózgu (Puigdellivol i wsp., 2019). Choroba zwyrodnieniowa stawów jest przyczyną 25% wizyt u lekarzy podstawowej opieki zdrowotnej (POZ) i najczęściej dotyczy największego stawu ludzkiego ciała – stawu kolanowego (często też biodrowego), regularnie podlegającemu przeciążeniom statycznym. Jednak może również wystąpić w obrębie kręgosłupa, małych stawach w kończynach czy w tkankach okołostawowych (Hunter, 2011).
Obecnie dostępne konwencjonalne metody leczenia OA są mało efektywne, a ponadto długotrwałe stosowanie środków farmakologicznych może powodować efekty toksyczne (Porfirio i Fanaro, 2016). Najczęściej stosowanym leczeniem objawowym u pacjentów z OA są nieopioidowe leki przeciwbólowe (np. paracetamol czy metamizol) oraz niesteroidowe leki przeciwzapalne (NLPZ, np. diklofenak czy naproksen), ale niestety wykazują poważne działania niepożądane, jak np. zaburzenia układu pokarmowego i/lub układu krążenia (szczególnie u osób starszych) (Bellamy i wsp., 1992; Puigdellivol i wsp., 2019).
Uwaga! Regularne przyjmowanie leków z grupy NLPZ zwiększa ryzyko choroby wrzodowej 10–30 razy! (Lazzaroni i Bianchi Porro, 2004).
Nie zaskakują więc obserwacje, że przewlekłe stosowanie tego typu leków może istotnie pogorszyć proces chorobowy, a w konsekwencji stan kliniczny pacjenta (Jerosch i wsp., 2008; Pavelka i wsp., 2002).
Badania nad patogenezą OA ujawniają jednak nowe metody zarówno w zakresie skutecznej profilaktyki, nowych testów diagnostycznych, jak i terapii. Przemysł farmaceutyczny dynamicznie zwiększa nakłady na badania i produkcję nowych, lepszych preparatów wpływających na hamowanie rozwoju i leczenie procesu chorobowego, związanego z OA. W uproszczeniu, mechanizm ich działania polega na zahamowaniu lub zwiększeniu roli mediatorów biologicznych w celu zachowania integralności strukturalnej stawów (Vista i Lau, 2011).
Zgodnie z celami wczesnej profilaktyki i na tle postępującego procesu starzenia się społeczeństw zachodnich, w tym społeczeństwa polskiego, pojawia się potrzeba wdrożenia efektywnych środków niefarmakologicznych i naturalnych metod wspierających zdrowie układu kostno-stawowego w jak najmłodszym wieku.
Już na początku XX wieku kilku badaczy zasugerowało, że niektóre substancje naturalne wykazują potencjał do naprawy uszkodzonej chrząstki stawowej lub przynajmniej spowalniają jej postępującą degradację (Brief i wsp., 2001). Przykładem preparatu, który został przebadany klinicznie, jest suplement diety w postaci hydrolizatu kolagenu (Moskowitz i wsp., 2001), choć w medycynie i dietetyce wykorzystywanych jest wiele form „kolagenowych wzmacniaczy zdrowia”. Zanim jednak przeanalizujemy znaczenie przyjmowania kolagenu z perspektywy osób zdrowych lub już „chorych na stawy”, należy najpierw wyjaśnić złożony proces etiopatogenezy OA, a więc jej przyczyn i przebiegu.
Spis treści
Biologia chrząstki stawowej
Chrząstka stawowa jest specyficznym rodzajem tkanki łącznej, wysoko wyspecjalizowaną, twardą, a jednocześnie elastyczną tkanką o niskim współczynniku tarcia i stosunkowo gładką powierzchnią stawową, co sprawia, że idealnie nadaje się do rozkładania obciążeń i amortyzowania wstrząsów związanych z działaniem sił fizycznych (np. typowych dla wielu dyscyplin sportu) (Pearle i wsp., 2005). Pisząc w skrócie, chrząstka stawowa spełnia de facto dwa zasadnicze zadania – amortyzacji i redukcji tarcia. Jednocześnie jest pozbawiona naczyń krwionośnych i limfatycznych, a także zakończeń nerwowych, co ma istotne znaczenie z punktu widzenia regeneracji tej tkanki. Niestety, w toku starzenia biologicznego chrząstka stawowa zużywa się u ludzi jak łożysko w samochodzie.
Z perspektywy histologicznej, chrząstka stawowa zbudowana jest z tkanki chrzęstnej szklistej (hialitowej), którą tworzą komórki tkanki chrzęstnej (liczne grupy chondrocytów). Tworzą one macierz chrząstki, która składa się z nieregularnie ułożonych włókien kolagenu, wielocukrów (makrocząsteczek proteoglikanów), kwasu hialuronowego oraz wody wiązanej przez glikozoaminoglikany (siarczan chondroityny i siarczan keratanu). Chondrocyty znajdują się w jamkach, zanurzone w macierzy międzykomórkowej oraz w macierzy zewnątrzkomórkowej (ang. extracellular matrix, ECM). Chondrocyty stanowią około 2–10% objętości chrząstki stawowej.
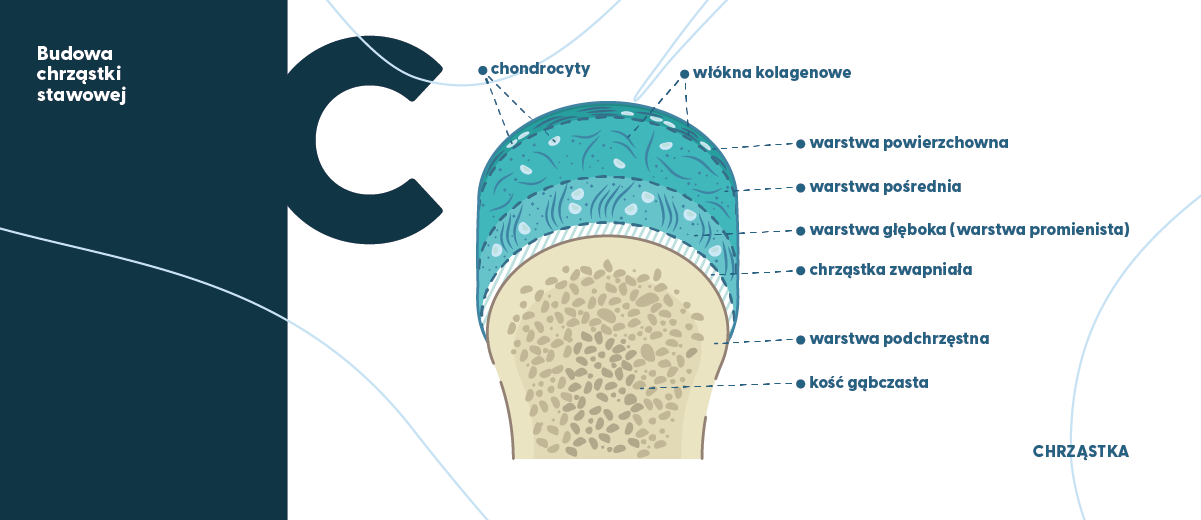
Liczne badania wykazały, że chondrocyty posiadają antygeny tkankowo-specyficzne, które indukują wprowadzenie przeciwciał u pacjentów z przeszczepami chrząstki, jak również u osób z OA (Ihyc i wsp., 2001). Chrząstkę stawową dzieli się na cztery strefy – powierzchowną, pośrednią, głęboką i zwapniałą – w zależności od morfologii, ułożenia włókien kolagenowych i zawartości proteoglikanów. Funkcję rusztowania spełnia unikatowy, przestrzenny układ włókien kolagenowych, których udział w suchej masie chrząstki wynosi około 60%, proteoglikany stanowią 25–35%, podczas gdy zawartość niekolagenowych białek i glikoprotein wynosi 15–20%. Kolageny są dużą rodziną białek w głównym stopniu tworzącą tkankę łączną u wszystkich organizmów wyższych. Do tej pory zidentyfikowano 29 typów kolagenu, podczas gdy jeszcze w 2000 roku znanych było ich tylko 19, co determinuje przewidywania, że w przyszłości naukowcy odkryją kolejne typy kolagenu w ludzkich tkankach (choć będą to raczej typy o marginalnym znaczeniu). Dominującym kolagenem chrząstki stawowej oraz krążków międzykręgowych jest kolagen typu II, który stanowi 90–95% całkowitej ilości kolagenu w tych strukturach tkankowych (u osób dorosłych) i ok. 75% (u płodu). Resztę tworzy kilka innych typów kolagenów (VI, IX, X, XI i XII). Kolagen typu II, podobnie jak elastyna oraz proteoglikany, jest produkowany przez komórki tkanki łącznej: fibroblasty (Poole, 2003). Dla porównania, najczęściej występujący w ludzkim organizmie kolagen typu I (kolagen fibrylarny), stanowi główny komponent kolagenu występującego w kościach (szkielet w ok. 95% składa się z kolagenu typu I) (Daneault i wsp., 2015). Chociaż ten typ kolagenu nie jest obecny w chrząstce stawowej, to bierze on aktywny udział w procesach regeneracji tkanki chrzęstnej. Ponadto wykazano, że niektóre chondrocyty mogą posiadać zdolność migracji, a jest to istotne dlatego, że migrujące chondrocyty mogą syntetyzować kolagen typu II, ale nie kolagen typu I (Morales, 2007). Może to być więc interpretowane jako kolejny dowód, że uszkodzenie stawu dotyczy głównie kolagenu typu II. Wykazano empirycznie, że kilka grup substancji jest zaangażowanych w regulację metabolizmu chrząstki stawowej, w tym cytokiny, czynniki wzrostu, kolagen typu II i fragmenty kolagenu, witaminy (np. witamina C), związki mineralne (np. krzem) i inne.
Najważniejszym problemem w terapii pacjentów z OA jest duża liczba procesów patogenetycznych. W postępowaniu z takimi pacjentami należy oczywiście uwzględnić interwencje terapeutyczne mające na celu kontrolę zarówno zawartości kolagenu w chrząstce stawowej, jak i w kościach. W ujęciu diagnostycznym, składniki kolagenu typu II (np. CTX-II), uwalniane podczas rozpadu kolagenu w tkance chrzęstnej, są uznawane za cenne biomarkery chorób stawów (Hao i wsp., 2019; Jansen i wsp., 2009). Ponadto, stosunek rozpadu kolagenu typu II do jego syntezy może być wykorzystany do przewidywania progresji uszkodzenia stawów (Cahue i wsp., 2007; Sharif i wsp., 2007). W kontekście aktualnie dostępnych metod oceny patofizjologii chrząstki stawowej, rozwój nauk medycznych jest naprawdę fascynujący!
Nutraceutyki i leki jako remedium osteoartrozy
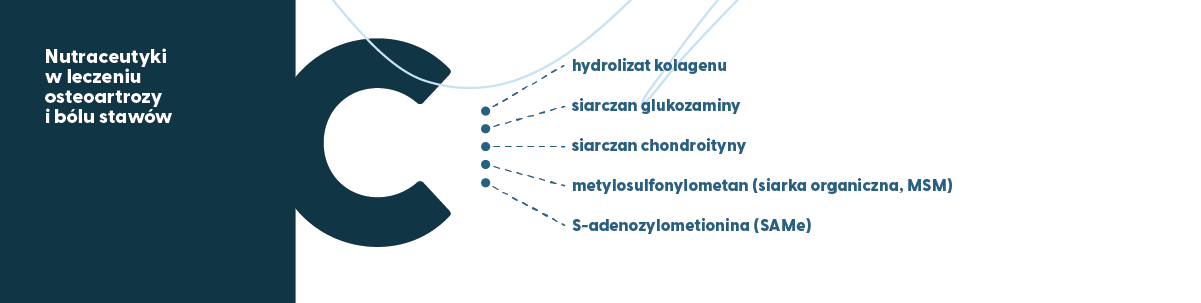
Nutraceutyki to substancje, które mogą działać jako adiuwanty (substancje wspomagające) w profilaktyce i leczeniu chorób przewlekłych, w szczególności OA (Ravalli i wsp., 2018; Wang i wsp,. 2019). Termin nutraceutyk pochodzi z połączenia angielskich słów „nutrition” i „pharmaceutical”. Do nutraceutyków zalicza się m. in. żywność funkcjonalną, suplementy diety a także pre- i probiotyki, a więc dotyczą one żywności lub produktów, które nie tylko zapewniają korzyści zdrowotne, ale także, z definicji i regulacji, są pozbawione działań niepożądanych (efektów ubocznych). Różne nutraceutyki (w formie suplementów diety) badano w leczeniu pacjentów z OA i bólami stawów. Należą do nich hydrolizat kolagenu, siarczan glukozaminy, siarczan chondroityny, metylosulfonylometan (siarka organiczna, MSM), S-adenozylometionina (SAMe) i wiele innych. Pomimo powszechnego stosowania niektórych z tych środków, istnieją niejednoznaczne wyniki badań naukowych dotyczące ich efektywności u pacjentów z OA (Leong i wsp., 2013).
Równolegle do terapii bazujących na nutraceutykach, w ciągu ostatnich dekad coraz większym zainteresowaniem naukowym cieszyły się leki modyfikujące przebieg choroby zwyrodnieniowej stawów (ang. disease-modifying osteoarthritis drugs, DMOADs). Te nowe substancje mają na celu zapobieganie lub zmniejszenie pogorszenia stanu tkanki chrzęstnej (efekt chondroprotekcyjny) (Qvist i wsp., 2008). Pochodne kolagenu są „molekularnymi kandydatami” na DMOAD, które są obecnie intensywnie badane. Trzy główne grupy pochodnych kolagenu oparte są na różnych stopniach hydrolizy kolagenu:
- kolagen niezdenaturowany, o masie cząsteczkowej 300 kDa (trzysta tysięcy Daltonów);
- żelatyna, o masie cząsteczkowej 20–90 kDa;
- hydrolizat kolagenu, o masie cząsteczkowej 2–9 kDa.
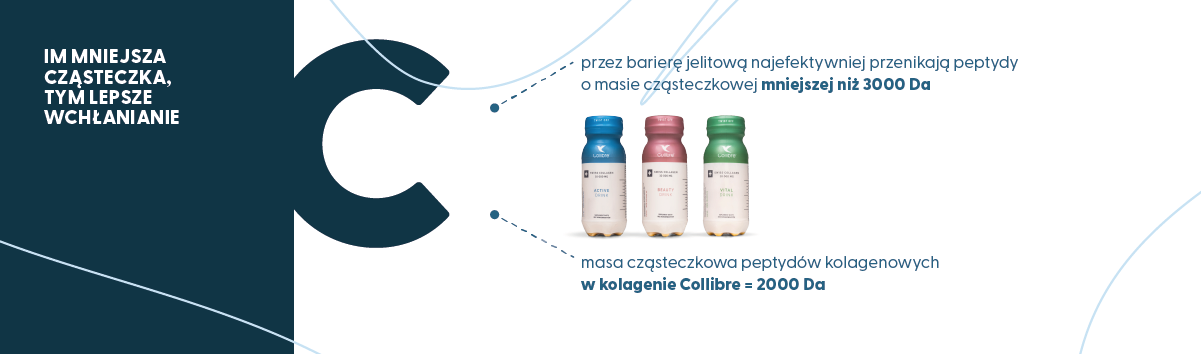
Zapamiętaj! Wiele doniesień naukowych sugeruje, że masa cząsteczkowa peptydów (nie tylko tych pochodzących z kolagenu) wykazuje ujemny związek ze współczynnikami przenikalności przez barierę jelitową (Hong i wsp., 2016; Wang i Li, 2017). W skrócie: IM MNIEJSZA CZĄSTECZKA, TYM LEPSZE WCHŁANIANIE (ABSORPCJA). Średnia masa cząsteczkowa (molekularna) hydrolizatów kolagenu dostępnych na rynku waha się między 2000 a 6000 Da (Moskowitz, 2000). Jednak zgodnie z najnowszymi wynikami badań (Guo i wsp., 2023), przez barierę jelitową najefektywniej przenikają peptydy o masie cząsteczkowej mniejszej niż 3000 Da (przy pomocy transportera peptydów 1 [PepT1], który należy do rodziny transporterów zależnych od jonów wodoru [H+]). Przypomnę tylko, że masa cząsteczkowa peptydów kolagenowych zawartych w suplemencie diety firmy Collibre wynosi 2000 Da.
Najbardziej obfite źródła żelatyny lub hydrolizatu kolagenu pochodzą od ssaków, a pozyskuje się je ze skóry świńskiej (46%), skóry bydlęcej (29,4%), oraz kości wieprzowych i bydlęcych (23,1%) (Gómez-Guillén i wsp., 2011). Kolagen doustny może być otrzymywany z produktu w sposób naturalny lub być przetwarzany przy użyciu enzymów. Podaje się, że różne pochodne kolagenu wykazują różne mechanizmy działania. Natywny (niezdenaturowany) kolagen typu II, czyli taki jak ten, który występuje w chrząstkach stawowych, wykorzystywany jest głównie u chorych na reumatoidalne zapalenie stawów (RZS). Uważa się, że jego głównym mechanizmem działania jest tzw. tolerancja doustna, co polega na zmniejszeniu reakcji autoimmunologicznych przeciwko kolagenowi chrząstki stawowej w odpowiedzi na doustne podanie antygenu (efekt immunosupresji) (Park i wsp., 2009). W bardziej szczegółowym ujęciu, ta odpowiedź immunologiczna jest wynikiem zmniejszonej ogólnoustrojowej nadwrażliwości typu opóźnionego, produkcji limfocytów T i cytokin oraz stłumionej odpowiedzi przeciwciał w surowicy krwi (Ju i wsp., 2008; Woo i wsp., 2017). Ogólnie rzecz biorąc, potwierdzono względnie wysoką efektywność doustnej suplementacji kolagenem typu II w RZS zarówno w badaniach przedklinicznych, jak i klinicznych. Tego typu suplementacja okazała się również znacznie bezpieczniejszą i bardziej tolerowaną opcją w porównaniu z istniejącymi terapiami immunosupresyjnymi (hamującymi funkcje układu immunologicznego), wykorzystującymi np. bardzo popularny lek cytostatyczny z grupy antymetabolitów: metotreksat, który jest pochodną kwasu foliowego. Jednak OA nie jest chorobą autoimmunologiczną, więc potencjalny efekt musi być wyjaśniony innym mechanizmem działania.
Chociaż często w celach profilaktycznych stosuje się kolagen natywny, niezdenaturowany, istnieje wiele badań klinicznych wykazujących pozytywny wpływ na strukturę i funkcje układu kostno-stawowego kolagenu hydrolizowanego (inaczej hydrolizat kolagenu lub peptydy kolagenowe). Badania te wykazały pozytywny wpływ peptydów kolagenowych, które posiadają krótkie sekwencje o długości około 2–20 aminokwasów, na m. in. odbudowę utraconej tkanki chrzęstnej u pacjentów z łagodną OA (McAlindon i wsp., 2011), zmniejszenie bólu stawów związanego z obciążeniami treningowymi u sportowców (Clark i wsp., 2008), wzmocnienie ścięgien i więzadeł u starszych mężczyzn i kobiet przed menopauzą (Jendricke i wsp., 2019; Praet i wsp., 2019; Zdzieblik i wsp., 2015), oraz zwiększenie gęstości mineralnej kości u kobiet po menopauzie (König i wsp., 2018). Badania te dotyczyły suplementacji dawkami od 2,5 do 15 g bioaktywnych peptydów kolagenowych przez okres od 3 do 18 miesięcy. Korzyści te tłumaczone są zdolnością bioaktywnych peptydów kolagenowych do zwiększania syntezy białek macierzy pozakomórkowej w różnych tkankach poprzez efekt stymulujący komórki, jednocześnie dostarczając specyficznych aminokwasów formujących włókna kolagenowe. Wykazano też, że po doustnym przyjęciu wyższych dawek kolagenu (ok. 10 g dziennie), uruchamiane są w organizmie biochemiczne procesy przeciwzapalne, immunomodulujące, antyoksydacyjne, antyrakowe i genoprotekcyjne (chroniące DNA), co tylko potwierdza, że kolagen stanowi potencjalny środek w zmniejszaniu stanu zapalnego w chorobach zapalnych stawów i tkanek okołostawowych (Chen i wsp., 2018; Vercruysse i wsp., 2005; Yang i wsp., 2010). Jednocześnie dysponujemy dowodami naukowymi na to, że niższe dawki suplementacyjne też są efektywne. Na przykład Kumar i wsp. (2014) w randomizowanym, podwójnie zaślepionym badaniu klinicznym nad wpływem peptydów kolagenowych (ang. collagen peptides, CPs) zastosowali dawkę 5 g/dobę u pacjentów z OA kolana. Po 13 tygodniach eksperymentu zaobserwowano statystycznie istotne zmniejszenie punktacji w skali WOMAC (ang. Western Ontario and McMaster Universities Index of Osteoarthritis), w porównaniu z grupą kontrolną (placebo). Wyjaśnię, że skala WOMAC pozwala monitorować postępy choroby zwyrodnieniowej stawów (kolanowych lub biodrowych) i/lub skuteczności leczenia przyczynowego i objawowego.
Istotnym aspektem jest to, że hydrolizat kolagenu jest uznawany za bezpieczny rodzaj żywności (ang. Generally Recognized As Safe, GRAS). Analizy toksyczności ostrej, podostrej, mutagennej i teratogennej, nie wykazały żadnego zagrożenia dla zdrowia. Jako przykład można wskazać badania Wu i wsp. (2004), którzy opisali wysokie bezpieczeństwo doustnego podawania hydrolizatu kolagenu w modelu szczurzym, podając dawki wynoszące 1660 mg/kg masy ciała na dobę (co odpowiada około 10-krotności oficjalnie rekomendowanych dawek dla ludzi). W tym kontekście należy stwierdzić, że doustne stosowanie preparatów w formie hydrolizatów kolagenu jest bezpieczne, a potencjalne efekty uboczne są bardzo rzadkie i minimalne. W dodatku skład hydrolizatów kolagenu charakteryzuje się stosunkowo wysoką ilością specyficznych aminokwasów: glicyny, proliny i hydroksyproliny (plus niewielkiej ilości cysteiny), które przy prawidłowym trawieniu są absorbowane przez barierę jelitową, dostają się do krążenia i są wykorzystywane w procesach metabolicznych różnych tkanek docelowych, preferencyjnie w chrząstce stawowej (Henrotin i wsp., 2011; Ohara i wsp., 2007).
W dyskusjach na temat kolagenu często pojawia się pytanie: czy żelatyna nie wystarczy? W ogólnej odpowiedzi należy zaznaczyć, że hydrolizat kolagenu i żelatyna wykazują właściwie ten sam mechanizm działania, ale różnią się istotnie pod względem biodostępności.

Jak już wcześniej wspomniano, masa cząsteczkowa – główny czynnik determinujący aktywność biologiczną składników funkcjonalnych – ma krytyczne znaczenie! Generalnie, efekty doustnego przyjmowania hydrolizatu kolagenu wynikają z dwóch głównych przyczyn: (1) zawartości określonych aminokwasów kolagenotwórczych (głównie glicyny i proliny) wpływających na właściwości chondrocytów w chrząstce stawowej [efekt budulcowy], oraz (2) bioaktywnością peptydów kolagenowych, które przekraczają błonę śluzową jelita cienkiego i migrują do fibroblastów w tkance łącznej [efekt sygnalizacyjny]. Wyjaśnijmy to teraz trochę dokładniej.
Jak już doskonale wiemy, kolagen jest dobrze poznanym źródłem funkcjonalnych peptydów o wysokiej aktywności biologicznej (Fu i wsp., 2018). Suplementy kolagenowe, w tym kolagen firmy Collibre, są bogate w aminokwasy takie jak glicyna, prolina i hydroksyprolina (często w kombinacji z różnymi kofaktorami, jak np. wit. C), ale teraz uwaga: oprócz istotnych funkcji w formowaniu chrząstki stawowej, aktywności przeciwzapalnej i antyoksydacyjnej, wykazano, że peptydy kolagenowe działają jako cząsteczki sygnalizacyjne (Paul i wsp., 2019)! Jest to kluczowe odkrycie, ponieważ przez wiele dekad dominował konserwatywny pogląd, że różne formy kolagenu dostarczają określonych aminokwasów wyłącznie jako surowca; było to myślenie na zasadzie „budujemy dom (tkankę) z cegiełek (aminokwasów z kolagenu)”. To prawda, natomiast inne mechanizmy wynikające z aktywności biologicznej cząsteczek kolagenu w organizmie nie były dokładnie wyjaśnione (szczególnie u ludzi). Obecnie już wiemy, że mikrocząsteczki kolagenu w postaci di- i tripeptydów (zwykle o masie cząsteczkowej poniżej 500 Da) wykazują specyficzną aktywność sygnalizacyjną, tj. migrują do różnych tkanek przekazując sygnał fibroblastom do produkcji kolagenu (Proksch i wsp., 2014), ale również elastyny oraz kwasu hialuronowego (Ohara i wsp., 2010). Te trzy związki tworzą w zasadzie królewski pakiet przeciwstarzeniowy (substancje anti-aging)! W okołostawowych procesach przeciwzapalnych istotne funkcje spełniają też monocyty, makrofagi i różne cytokiny. I to nie jest żadna czarna magia, bo już pod koniec XX wieku badania na modelu zwierzęcym (myszach) wykazały, że po doustnym podaniu radioznakowanego hydrolizatu kolagenu radioaktywność została wykryta… w chrząstce stawowej (Oesser i wsp., 1999). Efekt ten wystąpił już po pojedynczym podaniu kolagenu!!! Te informacje potwierdzają zdolność peptydów kolagenowych do akumulacji w strukturach tkanki łącznej (chrząstce stawowej, skórze, nerkach etc.), a więc zdecydowanie uzasadniają regularną suplementację.

Graficzne ujęcie koncepcji dostarczania peptydów kolagenopochodnych do stawu maziowego. Możliwy mechanizm immunometabolicznego i fenotypowego przeprogramowania makrofagów przez peptydy pochodzące z ultrahydrolizowanego i hydrolizowanego kolagenu.
Dowody naukowe wskazują, że stosowanie peptydów kolagenowych jako funkcjonalnych składników codziennej diety, zwiększa obrót kolagenu w organizmie bardziej efektywnie niż średnia mieszanka białek występująca w powszechnych zachodnich modelach dietetycznych (Hou i wsp., 2015; Meléndez-Hevia i wsp., 2009). W odniesieniu do całkowitego dziennego spożycia białka, efektywne ilości funkcjonalnych peptydów kolagenowych zalecane w piśmiennictwie naukowym (zakres 2,5 g do 15 g) były poniżej maksymalnego poziomu kolagenu, który może być włączony jako substytut białka w dietach spełniających minimalne zalecane spożycie białka (ang. Recommended Dietary Allowance, RDA) (Baar, 2019; Praet i wsp., 2019). W dodatku, możliwe jest wystąpienie efektów synergicznych z określonymi produktami spożywczymi, tzn. wchłanianie cząsteczek kolagenu może ulec poprawie, gdy np. hydrolizat kolagenu jest dostarczany razem z fermentowanym napojem mlecznym (zsiadłym mlekiem) (Walrand i wsp., 2008).
CIEKAWOSTKA: W kilku badaniach wykazano, że hydrolizat kolagenu pochodzenia drobiowego i wołowego wpływa… na zmniejszenie ciśnienia krwi u zwierząt i u ludzi, dlatego jeden z potencjalnych mechanizmów działania hydrolizatów kolagenu dotyczy układu naczyniowego (Faria i wsp., 2008; Saiga-Egusa i wsp., 2009; Zhang i wsp., 2010). Jest to bardzo prawdopodobne zjawisko, biorąc pod uwagę związek między OA a miażdżycą naczyń krwionośnych kości podchrzęstnej, co sugerują badania epidemiologiczne (Conaghan i wsp., 2005). Te informacje są istotne dla wszystkich osób z nadciśnieniem tętniczym, których według aktualnych statystyk jest w Polsce ok. 12 milionów (nawet 75% osób w wieku 65 lat i starszych choruje na nadciśnienie tętnicze).
A może kolagen dla pieska?
Jako kolejną ciekawostkę można dodać, że badano efektywność terapeutyczną oraz bezpieczeństwo stosowania niezdenaturowanego (natywnego) kolagenu typu II pojedynczo, lub w połączeniu z siarczanem glukozaminy oraz chondroityny u… psów z artretyzmem (d’Altilio i wsp., 2007). Wyniki tych badań ujawniły, że zarówno zastosowanie niezdenaturowanego kolagenu typu II, jak i w kombinacji z siarczanem glukozaminy oraz chondroityny, wyraźnie łagodzi ból związany z artretyzmem, a suplementy te są dobrze tolerowane, gdyż nie zaobserwowano żadnych skutków ubocznych. W innym badaniu oceniającym efektywność kliniczną i bezpieczeństwo stosowania kolagenu typu II (UC-II), psy z otyłością otrzymujące UC-II w dawce 1 lub 10 mg UC-II/dobę przez 90 dni, doświadczyły zmniejszenia ogólnego poziomu bólu, kulawizny i bólu podczas manipulacji kończynami po ćwiczeniach fizycznych, przy czym dawka 10 mg powodowała znacznie większą poprawę. Ponadto, psy otrzymujące UC-II przez 90 dni wykazały wzrost poziomu aktywności fizycznej (Deparle i wsp., 2005).
Podsumowanie
Patofizjologia osteoartrozy jest bardziej skomplikowanym procesem niż tylko „zużywanie się” chrząstki stawowej. Nie jest to choroba pojedynczej tkanki, ale choroba, która obejmuje cały staw. Opracowanie bezpiecznych i skutecznych metod leczenia OA (oraz RZS) stanowi duże wyzwanie naukowe i praktyczne. Obecnie dostępne metody leczenia służą raczej łagodzeniu objawów tych chorób, niż leczeniu przyczynowemu. Zainteresowanie doustnymi suplementami kolagenowymi (peptydami kolagenowymi), zapoczątkowało badania przedkliniczne i kliniczne nad ich profilem bezpieczeństwa i efektywnością działania. Badania przedkliniczne potwierdziły, że podstawowy mechanizm działania niezdenaturowanego (natywnego) kolagenu doustnego skupia się na procesie tolerancji doustnej, podczas gdy mechanizm działania kolagenu częściowo zdenaturowanego (hydrolizatu) może potencjalnie prowadzić do stymulacji produkcji składników macierzy pozakomórkowej. Zgodnie z najnowszymi badaniami, peptydy kolagenowe funkcjonują jako cząsteczki sygnalizacyjne i preferencyjnie gromadzą się w chrząstce stawowej, co ma istotne znaczenie profilaktyczne, jak i kliniczne. W generalnym ujęciu, kolagen doustny okazał się efektywny w osteoartrozie, gdy podawany jest w postaci niezdenaturowanej lub częściowo zdenaturowanej (inaczej zhydrolizowanej), chociaż nie przeprowadzono wystarczającej ilości badań na dużą skalę i w dłuższym okresie czasu (tj. badań longitudinalnych), aby skonsolidować aktualne wyniki. Efektywność kolagenu doustnego w przypadku chorób autoimmunologicznych, takich jak RZS, jest trochę mniejsza, ponieważ wykazał on lepszą odpowiedź w porównaniu do placebo (substancja neutralna), ale nie w porównaniu z metotreksatem, czyli podstawowym lekiem stosowanym w RZS. Kolagen doustny wyróżnia się jednak lepszą tolerancją i profilem bezpieczeństwa, a więc warto go stosować w ramach profilaktyki, natomiast u pacjentów z chorobami układu kostno-stawowego stanowi aktualnie bardziej atrakcyjną terapię w stosunku do potencjalnie niebezpiecznej farmakoterapii.
Piśmiennictwo
[1] Allen, K.D., Thoma, L.M., Golightly, Y.M. (2022). Epidemiology of osteoarthritis. Osteoarthritis and cartilage, 30(2), 184-195.
[2] Baar, K. (2019). Stress relaxation and targeted nutrition to treat patellar tendinopathy. Int. J. Sports Nutr. Exerc. Metab, 4, 1-5.
[3] Bellamy, N., Carette, S., Ford, P.M., Kean, W.F., le Riche, N.G., Lussier, A., … Campbell, J. (1992). Osteoarthritis antirheumatic drug trials. II. Tables for calculating sample size for clinical trials. The Journal of rheumatology, 19(3), 444-450.
[4] Brief, A.A., Maurer, S.G., Di Cesare, P.E. (2001). Use of glucosamine and chondroitin sulfate in the management of osteoarthritis. J Am Acad Orthop Surg 9, 71-78.
[5] Cahue, S., Sharma, L., Dunlop, D., Ionescu, M., Song, J., Lobanok, T., … Poole, A.R. (2007). The ratio of type II collagen breakdown to synthesis and its relationship with the progression of knee osteoarthritis. Osteoarthritis and cartilage, 15(7), 819-823.
[6] Chen, Y. P., Liang, C. H., Wu, H. T., Pang, H. Y., Chen, C., Wang, G. H., & Chan, L. P. (2018). Antioxidant and anti-inflammatory capacities of collagen peptides from milkfish (Chanos chanos) scales. Journal of Food Science and Technology, 55, 2310-2317.
[7] Clark, K. L., Sebastianelli, W., Flechsenhar, K. R., Aukermann, D. F., Meza, F., Millard, R. L., … Albert, A. (2008). 24-Week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain. Current Medical Research and Opinion, 24(5), 1485-1496.
[8] Conaghan, P. G. (2013). Parallel evolution of OA phenotypes and therapies. Nature Reviews Rheumatology, 9(2), 68-70.
[9] Conaghan, P.G., Vanharanta, H., Dieppe, P.A. (2005). Is progressive osteoarthritis an atheromatous vascular disease?. Annals of the Rheumatic Diseases, 64(11), 1539-1541.
[10] d’Altilio, M., Peal, A., Alvey, M., Simms, C., Curtsinger, A., Gupta, R. C., … Bagchi, D. (2007). Therapeutic efficacy and safety of undenatured type II collagen singly or in combination with glucosamine and chondroitin in arthritic dogs. Toxicology Mechanisms and Methods, 17(4), 189-196.
[11] Daneault, A., Prawitt, J., Fabien Soulé, V., Coxam, V., Wittrant, Y. (2017). Biological effect of hydrolyzed collagen on bone metabolism. Critical Reviews in Food Science and Nutrition, 57(9), 1922-1937.
[12] Deparle, L.A., Gupta, R.C., Canerdy, T.D., Goad, J.T., D’Altilio, M., Bagchi, M., Bagchi, D. (2005). Efficacy and safety of glycosylated undenatured type-II collagen (UC-II) in therapy of arthritic dogs. J. Vet. Pharmacol. Ther, 28, 385-390.
[13] Faria, M., da Costa, E.L., Gontijo, J.A.R., Netto, F.M. (2008). Evaluation of the hypotensive potential of bovine and porcine collagen hydrolysates. Journal of Medicinal Food, 11(3), 560-567.
[14] Fu, Y., Therkildsen, M., Aluko, R.E., Lametsch, R. (2018). Exploration of collagen recovered from animal by-products as a precursor of bioactive peptides: Successes and challenges. Crit. Rev. Food Sci. Nutr. 2, 1-17.
[15] Gómez-Guillén, M.C., Giménez, B., López-Caballero, M.E., Montero, M.P. (2011). Functional and bioactive properties of collagen and gelatin from alternative sources: A review. Food Hydrocolloids, 25(8), 1813-1827.
[16] Guo, Z., Yang, Y., Hu, B., Zhu, L., Liu, C., Li, M., Gu, Z., Xin ,Y., Guo, Z., Sun, H., Guan, Y., Zhang, L. (2023). The Bioaccessibility of Yak Bone Collagen Hydrolysates: Focus on Analyzing the Variation Regular of Peptides and Free Amino Acids. Foods, 12(5), 1003.
[17] Hao, H.Q., Zhang, J.F., He, Q.Q., Wang, Z. (2019). Cartilage oligomeric matrix protein, C-terminal cross-linking telopeptide of type II collagen, and matrix metalloproteinase-3 as biomarkers for knee and hip osteoarthritis (OA) diagnosis: a systematic review and meta-analysis. Osteoarthritis and Cartilage, 27(5), 726-736.
[18] Hayami, T., Pickarski, M., Zhuo, Y., Wesolowski, G.A., Rodan, G.A., Duong, L.T. (2006). Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis. Bone, 38(2), 234-243.
[19] Henrotin, Y., Lambert, C., Couchourel, D., Ripoll, C., Chiotelli, E. (2011). Nutraceuticals: do they represent a new era in the management of osteoarthritis?–a narrative review from the lessons taken with five products. Osteoarthritis and Cartilage, 19(1), 1-21.
[20] Hong, S.M., Tanaka, M., Koyanagi, R., Shen, W., Matsui, T. (2016). Structural Design of Oligopeptides for Intestinal Transport Model. J. Agric. Food. Chem., 64, 2072-2079.
[21] Hou, Y., Yin, Y., Wu, G. (2015). Dietary essentiality of “nutritionally non-essential amino acids” for animals and humans. Exp. Biol. Med., 240, 997-1007.
[22] Hunter, D.J. (2011). Pharmacologic therapy for osteoarthritis–the era of disease modification. Nat Rev Rheumatol, 7, 13-22.
[23] Ihyc, A., Osiecka-Iwan, A., Jozwiak, J., Moskalewski, S. (2001). The morphology and selected biological properties of articular cartilage. Ortop Traumatol Rehabil, 3(2), 151-162.
[24] Jansen, N.W., Roosendaal, G., Lundin, B., Heijnen, L., Mauser‐Bunschoten, E., Bijlsma, J.W., … Lafeber, F.P. (2009). The combination of the biomarkers urinary C‐terminal telopeptide of type II collagen, serum cartilage oligomeric matrix protein, and serum chondroitin sulfate 846 reflects cartilage damage in hemophilic arthropathy. Arthritis & Rheumatism, 60(1), 290-298.
[25] Jendricke, P., Centner, C., Zdzieblik, D., Gollhofer, A., König, D. (2019). Specific collagen peptides in combination with resistance training improve body composition and regional muscle strength in premenopausal women: a randomized controlled trial. Nutrients, 11(4), 892.
[26] Jerosch, J., Verdonk, R., Trč, T., Price, A., Bailleul, F., van Dijk, N.C. (2008). Efficacy and safety of a single dose of Hylan G-20 vs. Placebo in patients with knee osteoarthritis pain. Knee Surgery Sport Traumatology Arthroscopy, 16(Suppl 1), 27-28.
[27] Ju, J.H., Cho, M.L., Jhun, J.Y., Park, M.J., Oh, H.J., et al. (2008). Oral administration of type-iI collagen suppresses IL-17-associated RANKL expression of CD4+ T cells in collagen-induced arthritis. Immunol Lett 117: 16-25.
[28] Kloppenburg, M., Berenbaum, F. (2020). Osteoarthritis year in review 2019: epidemiology and therapy. Osteoarthr Cartil, 28, 242-248.
[29] König, D., Oesser, S., Scharla, S., Zdzieblik, D., Gollhofer, A. (2018). Specific collagen peptides improve bone mineral density and bone markers in postmenopausal women – a randomized controlled study. Nutrients, 10(1), 97.
[30] Kumar, S., Sugihara, F., Suzuki, K., Inoue, N., Venkateswarathirukumara, S. (2015). A double‐blind, placebo‐controlled, randomised, clinical study on the effectiveness of collagen peptide on osteoarthritis. Journal of the Science of Food and Agriculture, 95(4), 702-707.
[31] Lazzaroni, M., Bianchi Porro, G. (2004). Gastrointestinal side-effects of traditional non-steroidal anti-inflammatory drugs and new formulations. Aliment Pharmacol Ther, 20(Suppl 2), 48-58.
[32] Leong, D.J., Choudhury, M., Hirsh, D.M., Hardin, J.A., Cobelli, N.J., Sun, H.B. (2013). Nutraceuticals: potential for chondroprotection and molecular targeting of osteoarthritis. International Journal of Molecular Sciences, 14(11), 23063-23085.
[33] Sharif, M., Kirwan, J., Charni, N., Sandell, L., Whittles, J.C., Garnero, P. (2007). A 5-yr longitudinal study of type IIA collagen synthesis and total type II collagen degradation in patients with knee osteoarthritis—association with disease progression, Rheumatology, 46(6), 938–943.
[34] McAlindon, T.E., Nuite, M., Krishnan, N., Ruthazer, R., Price, L.L., Burstein, D., … Flechsenhar, K. (2011). Change in knee osteoarthritis cartilage detected by delayed gadolinium enhanced magnetic resonance imaging following treatment with collagen hydrolysate: a pilot randomized controlled trial. Osteoarthritis and Cartilage, 19(4), 399-405.
[35] Meléndez-Hevia, E., De Paz-Lugo, P., Cornish-Bowden, A., Cárdenas, M.L., Paz-Lugo, P. (2009). A weak link in metabolism: the metabolic capacity for glycine biosynthesis does not satisfy the need for collagen synthesis. J. Biosci, 34, 853-872.
[36] Morales, T.I. (2007). Chondrocyte moves: clever strategies? Osteoarthritis Cartilage, 15(8), 861-871.
[37] Moskowitz, R.W. (2000). Role of collagen hydrolysate in bone and joint disease. Semin Arthritis Rheum, 30, 87-99.
[38] Oesser, S., Adam, M., Babel, W., Seifert, J. (1999). Oral administration of (14)C labeled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL). J Nutr, 129(10), 1891-1895.
[39] Ohara, H., Ichikawa, S., Matsumoto, H., Akiyama, M., Fujimoto, N., Kobayashi, T., Tajima, S. (2010). Collagen-derived dipeptide, proline-hydroxyproline, stimulates cell proliferation and hyaluronic acid synthesis in cultured human dermal fibroblasts. J Dermatol, 37, 330-338.
[40] Ohara, H., Matsumoto, H., Ito, K., Iwai, K., Sato, K. (2007). Comparison of quantity and structures of hydroxyproline-containing peptides in human blood after oral ingestion of gelatin hydrolysates from different sources. J Agric Food Chem, 55(4), 1532-1535.
[41] Oliveria, S.A., Felson, D.T., Reed, J.I., et al. (1995). Incidence of symptomatic hand, hip, and knee osteoarthritis among patients in a health maintenance organization. Arthritis Rheum, 38:1134-1141.
[42] Park, K.S., Park, M.J., Cho, M.L., Kwok, S.K., Ju, J.H., Ko, H.J., … Kim, H.Y. (2009). Type II collagen oral tolerance; mechanism and role in collagen-induced arthritis and rheumatoid arthritis. Modern Rheumatology, 19(6), 581-589.
[43] Paul, C., Leser, S., Oesser, S. (2019). Significant amounts of functional collagen peptides can be incorporated in the diet while maintaining indispensable amino acid balance. Nutrients, 11(5), 1079.
[44] Pavelka, K., Trč, T., Karpaš, K., Moster, R., Audy, P. (2002). Treatment of knee osteoarthritis by intraarticular application of Hyalgan: clinical praxis experiences in Czech Republic. Acta Chir Orthop Traum Čech, 69, 302-304.
[45] Pearle, A.D., Warren, R.F., Rodeo, S.A. Basic science of articular cartilage and osteoarthritis. Clin Sports Med 2005;24:1-12.
[46] Poole, A.R. (2003). Biochemical/immunochemical biomarkers of osteoarthritis: utility for prediction of incident or progressive osteoarthritis. Rheum Dis Clin North Am 29: 803-818.
[47] Porfírio, E., & Fanaro, G. B. (2016). Collagen supplementation as a complementary therapy for the prevention and treatment of osteoporosis and osteoarthritis: a systematic review. Revista Brasileira de Geriatria e Gerontologia, 19, 153-164.
[48] Praet, S.F.E.; Purdam, C.R.; Welvaert, M.; Vlahovich, N.; Lovell, G.; Burke, L.M.; Gaida, J.E.; Manzanero, S.; Hughes, D.; Waddington, G. Oral supplementation of specific collagen peptides combined with calf-strengthening exercises enhances function and reduces pain in Achilles tendinopathy patients. Nutrients 2019, 11, 76.
[49] Proksch, E., Schunck, M., Zague, V., Segger, D., Degwert, J., Oesser, S. (2014). Oral intake of specific bioactive collagen peptides reduces skin wrinkles and increases dermal matrix synthesis. Skin Pharmacol Physiol, 27, 113-119.
[50] Puigdellivol, J., Comellas Berenger, C., Pérez Fernández, M.Á., Cowalinsky Millán, J.M., Carreras Vidal, C., Gil Gil, I., … Aguilar Hernández, M.E. (2019). Effectiveness of a dietary supplement containing hydrolyzed collagen, chondroitin sulfate, and glucosamine in pain reduction and functional capacity in osteoarthritis patients. Journal of Dietary Supplements, 16(4), 379-389.
[51] Qvist, P., Bay-Jensen, A.C., Christiansen, C., Dam, E.B., Pastoureau, P., Karsdal, M.A. (2008). The disease modifying osteoarthritis drug (DMOAD): is it in the horizon?. Pharmacological Research, 58(1), 1-7.
[52] Ravalli, S., Szychlinska, M.A., Leonardi, R.M., Musumeci, G. (2018). Recently highlighted nutraceuticals for preventive management of osteoarthritis. World Journal of Orthopedics, 9(11), 255.
[53] Saiga-Egusa, A., Iwai, K., Hayakawa, T., Takahata, Y., Morimatsu, F. (2009). Antihypertensive effects and endothelial progenitor cell activation by intake of chicken collagen hydrolysate in pre-and mild-hypertension. Bioscience, biotechnology, and biochemistry, 73(2), 422-424.
[54] Sarzi-Puttini, P., Cimmino, M.A., Scarpa, R., Caporali, R., Parazzini, F., Zaninelli, A., … Canesi, B. (2005, August). Osteoarthritis: an overview of the disease and its treatment strategies. In Seminars in arthritis and rheumatism (Vol. 35, No. 1, pp. 1-10). WB Saunders.
[55] Vercruysse, L., Van Camp, J., Smagghie, G. (2005). ACE inhibitory peptides derived from enzymatic hydrolysates of animal muscle protein: a review. J Agric Food Chem, 53, 8106–8115.
[56] Vista, E.S., Lau, C.S. (2011). What about supplements for osteoarthritis? A critical and evidenced‐based review. International Journal of Rheumatic Diseases, 14(2), 152-158.
[57] Walrand, S., Chiotelli, E., Noirt, F., Mwewa, S., Lassel, T. (2008). Consumption of a functional fermented milk containing collagen hydrolysate improves the concentration of collagen-specific amino acids in plasma. Journal of Agricultural and Food Chemistry, 56(17), 7790-7795.
[58] Wang, A., Leong, D.J., Cardoso, L., Sun, H.B. (2018). Nutraceuticals and osteoarthritis pain. Pharmacology & therapeutics, 187, 167-179.
[59] Wang, B., Li, B. (2017). Effect of molecular weight on the transepithelial transport and peptidase degradation of casein-derived peptides by using Caco-2 cell model. Food. Chem. 218, 1-8.
[60] Woo, T., Lau, L., Cheng, N., Chan, P., Tan, K., Gardner, A. (2017). Efficacy of oral collagen in joint pain-osteoarthritis and rheumatoid arthritis. Journal of Arthritis, 6(2), 1-4.
[61] Wu, J., Fujioka, M., Sugimoto, K., Mu, G., Ishimi, Y. (2004). Assessment of effectiveness of oral administration of collagen peptide on bone metabolism in growing and mature rats. J Bone Miner Metab, 22(6), 547-553.
[62] Yang, L., Chen, L., Zeng, R., et al. (2010). Synthesis, nanosizing and in vitro drug release of a novel anti-HIV polymeric prodrug: chitosan-O-isopropyl-5′-O-d4T monophosphate conjugate. Bioorg Med Chem, 18, 117-23.
[63] Zdzieblik, D., Oesser, S., Baumstark, M. W., Gollhofer, A., König, D. (2015). Collagen peptide supplementation in combination with resistance training improves body composition and increases muscle strength in elderly sarcopenic men: a randomised controlled trial. British Journal of Nutrition, 114(8), 1237-1245.
[64] Zhang, Y., Kouguchi, T., Shimizu, M., Ohmori, T., Takahata, Y., Morimatsu, F. (2010). Chicken collagen hydrolysate protects rats from hypertension and cardiovascular damage. Journal of medicinal food, 13(2), 399-405.
Więcej artykułów

11 min. czytania
Soki dla dzieci – co jest zdrowe? Co podawać dziecku?
12 min. czytania
Cellulit – dlaczego powstaje i jak się go pozbyć?

13 min. czytania






























