Wpływ glikacji na kolagen a proces starzenia biologicznego

Artykuł eksperta dr Michała Boraczyńskiego
Proces starzenia biologicznego przebiega u ludzi w różnym tempie i często nie jest zgodny z ich wiekiem chronologicznym. Proces glikacji białek (nieenzymatycznej glikozylacji), polegający na powstawaniu nieenzymatycznych wiązań krzyżowych w formie zaawansowanych (końcowych) produktów glikacji (AGEs, ang. advanced glycation end-products), jest jednym z kluczowych patomechanizmów przedwczesnego starzenia. Białka o budowie włóknistej, które pełnią funkcje podporowe, tj. białka fibrylarne (należy do nich kolagen) są bardzo podatne na proces glikacji. AGEs powodują destrukcję wielu struktur komórkowych – zarówno bezpośrednio, jak i pośrednio – przez indukowanie stresu oksydacyjnego i zjawiska gliko- oraz lipoksydacji. Szkodliwe cząsteczki AGE gromadzą się głównie w białkach o stosunkowo długim okresie półtrwania i dlatego bardzo negatywnie wpływają na elastyczność tkanki kolagenowej i ich strukturę molekularną. Względne tempo akumulacji AGEs w kolagenie wynosi około 3,7% na rok. Objawia się to m. in. zmianami wyglądu skóry (zmarszczki), postępującej sztywności mięśni szkieletowych i stawów, zmniejszeniu wysokości ciała, a także usztywnienia naczyń krwionośnych i struktur płucnych. W dodatku endogenna (wewnętrzna) synteza kolagenu nieustannie się obniża wraz z wiekiem.

Współczesna dieta jest niestety uboga w żywność pobudzającą produkcję endogennego kolagenu i elastyny. Aktualnie naukowcy zwracają coraz większą uwagę na hydrolizaty białkowe, w tym kolagenowe, jako potencjalne suplementy diety. Peptydy kolagenowe (ang. collagen peptides – CPs) są wykorzystywane jako ważne składniki aktywne ze względu na ich różnorodną bioaktywność, wysoką biodostępność i dobrą biokompatybilność. Badania naukowe potwierdziły istotne znaczenie hydrolizatów kolagenowych różnego pochodzenia (rybiego, wołowego i innych) w uzupełnianiu niedoborów kolagenu oraz stymulowania efektów „anti-aging” (przeciwstarzeniowych). Z powodu chronicznej ekspozycji ludzi na wiele czynników ryzyka zdrowotnego, zalecana dawka kolagenu wynosi nawet 10 g dziennie (szeroki zakres to 2,5–10 g). Poza tym kolagen powinien być dobrze zhydrolizowany (pocięty), bo dopiero mikroskopijne peptydy (<2000 Da) są łatwo absorbowane i mogą wykazywać potencjalnie korzystne efekty biologiczne. Wszystkie te właściwości zapewnia szwajcarski kolagen oferowany przez firmę „Collibre”.

Spis treści
Proces starzenia się
Postępujący spadek wszystkich funkcji życiowych organizmu, który kończy się śmiercią – przebiega u ludzi w różnym tempie. Niektórzy ludzie wydają się „starzy” jak na swój wiek kalendarzowy, a inni pozostają „młodsi” niż wskazuje ich metryka. Jasne jest, że z punktu widzenia biologii postępu wieku człowieka nie da się mierzyć wyłącznie na podstawie chronologii. Naukowcy nie zakładają już, że brak aktywności czy dysfunkcja jednego organu, takiego jak przysadka mózgowa lub gruczoły płciowe, determinuje długość życia organizmu jako całości. Wręcz przeciwnie, poszukuje się wskazówek do zrozumienia procesu starzenia biologicznego w zmianach, które postępują w sposób ciągły w całym organizmie i dotyczą molekularnych składników jego tkanek.
I w tym kontekście pojawia się „na scenie” magiczna molekuła życia: KOLAGEN.
Kolagen
(z greki cola [klej] genno [rodzić] – klejorodny) to naturalny polimer i nierozpuszczalne w wodzie kwasochłonne białko strukturalne tworzące włókno kolagenowe, które stanowi nawet 30 procent wszystkich białek w ludzkim organizmie, a więc jest to najbardziej reprezentowane białko w naszym ustroju (jak i u wszystkich ssaków, ptaków i ryb).

Kolagen, podobnie jak kwas hialuronowy i elastyna, powstaje w fibroblastach, czyli komórkach tkanki łącznej występujących w skórze właściwej. W celu wyjaśnienia niezwykłej dynamiki obrotu kolagenu w poszczególnych tkankach można wykorzystać przykład aktywności fibroblastów w mięśniu sercowym, gdzie fibroblast przetwarza ok. 3,5 mln mole-kuł protokolagenu (prekursora w pełni dojrzałego kolagenu) na godzinę (Grajek, 2009).
Kolagen możemy sobie wyobrazić jako „gorący klej”. W ujęciu naukowym, kolagen to polipeptyd – prawoskrętna alfa-helisa tripeptydowa (tworząca kolagen) składający się z różnych aminokwasów, m.in. glicyny, argininy, proliny, hydroksyproliny i hydroksylizyny. Należy jednak zwrócić uwagę, że spośród wymienionych związków trzy są dominujące: glicyna (Gly), prolina (Pro), oraz hydroksyprolina (Hyp). Co więcej, w tym „aminokwasowym trójkącie” glicyna jest aminokwasem najważniejszym – jej zawartość w kolagenie wynosi prawie 1/3 wszystkich aminokwasów. Dlatego w cząsteczce kolagenu powtarza się sekwencja -Gly-Pro-Y-Gly-Pro-Y- (gdzie Y oznacza dowolny aminokwas – głównie jest to hydroksyprolina). Poza aminokwasami, kolagen zawiera jedynie polisacharydy – zazwyczaj do 2% i cukry proste – zazwyczaj poniżej 1%.
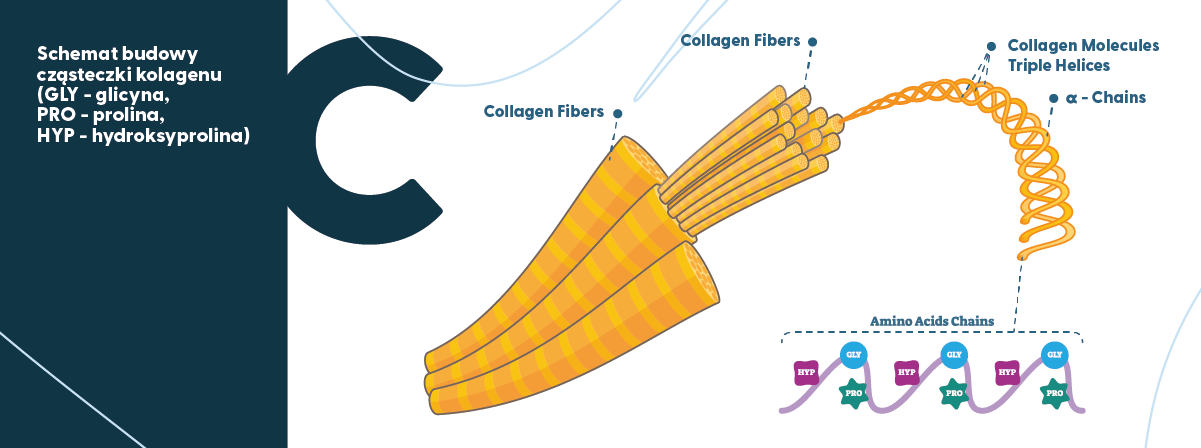
Dotychczas zidentyfikowano 29 różnych typów kolagenu u ludzi i prawdopodobnie w przyszłości zostaną odkryte kolejne. Najpopularniejszymi typami są kolagen typu 1 i 3 (często występują łącznie) oraz kolagen typu 2, ale de facto 90% kolagenu w ludzkim organizmie stanowi kolagen typu 1.
Od ponad 50 lat wiadomo, że kolagen ulega stopniowej stabilizacji wraz z wiekiem (Hamlin & Kohn, 1971). Proces stabilizacji kolagenu polega na systematycznym wzroście międzycząsteczkowych i międzywęzłowych wiązań krzyżowych i jednoczesnym spadku podatności kolagenu na trawienie kolagenazą (Davis i in., 1975; Vater i in., 1979; Monnier i in., 2005). Kolagenaza to zbiorcza nazwa enzymów należących do metaloproteinaz (grupa enzymów proteolitycznych), które mają zdolność rozkładania naturalnego kolagenu. Nawiasem mówiąc, te enzymy mają bardzo szerokie zastosowanie medyczne, ponieważ są wykorzystywane w leczeniu oparzeń i owrzodzeń, a także w nowoczesnej redukcji blizn. Spadek wrażliwości na endogenne enzymy kolagenolityczne wydaje się być zjawiskiem uwarunkowanym genetycznie. Na przykład, poziom strawności kolagenu jest od dawna wykorzystywany do szacowania wieku chronologicznego danego osobnika (Hamlin i Kohn, 1972). Istotne jest to, że oporny na proteolizę (enzymatyczne rozszczepienie wiązania peptydowego) kolagen typu I (najlepiej poznany z 29 typów kolagenu), jest nie tylko biomarkerem starzenia, ale sam może promować starzenie biologiczne (Vafaie i wsp., 2014).
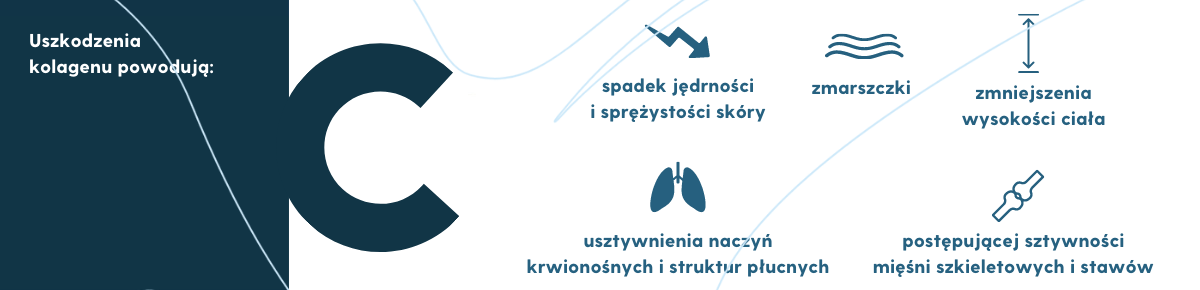
Wyniki wielu badań laboratoryjnych wykazały, że wraz z wiekiem kolagen kumuluje uszkodzenia (patologiczne zmiany) w swojej strukturze molekularnej (np. występują zmiany konformacji przestrzennej czy wolniejszy przebieg proteolizy), które negatywnie wpływają na jego integralność i funkcje (np. utrata właściwości mechanicznych, spadek jędrności i sprężystości skóry). Utrata tych właściwości prowadzi do zmian wyglądu skóry (zmarszczki), postępującej sztywności mięśni szkieletowych i stawów, zmniejszenia wysokości ciała, a także usztywnienia naczyń krwionośnych i struktur płucnych (Bailey, 2002; Haus i wsp., 2007; Saito i Marumo, 2015).
Na tym tle mogą się rozwinąć kolagenozy, tj. przewlekłe układowe choroby tkanki łącznej o podłożu autoimmunologicznym. Badania procesów starzenia kolagenu, co można zmierzyć przy wykorzystaniu nieinwazyjnych, specjalistycznych metod i aparatury badawczej (zwykle są to analizy immunologiczne i techniki chromatograficzne), dostarczają obiektywnych danych do określenia wieku biologicznego ludzi.
GLIKACJA – motor napędowy starzenia biologicznego
Wśród wielu związanych z wiekiem zmian strukturalno-funkcjonalnych tkanek człowieka, charakterystyczny jest wzrost częstości uszkodzeń tkanek z jednoczesnym obniżeniem zdolności do ich gojenia (Bailey, 2001). Chociaż przyczyny tych zmian są wieloczynnikowe, to jednak wieloetapowy proces glikacji białek (nieenzymatycznej glikozylacji), odkryty w 1912 roku, który polega na powstaniu nieenzymatycznych wiązań krzyżowych w formie zaawansowanych (końcowych) produktów glikacji (AGEs, ang. advanced glycation end-products), jest coraz częściej uważany za kluczowy patomechanizm przedwczesnego starzenia (Snedeker i Gautieri, 2014). AGEs zostały powiązane z procesami chorobowymi i starzeniem się (Alt i wsp., 2004; Brown i wsp., 2005; Monnier i wsp., 2005; Reddy, 2004) oraz wykazano, że są silnie skorelowane ze wzrostem stężenia glukozy w surowicy krwi i wiekiem biologicznym. Obecnie wiadomo, że AGEs powodują destrukcję wielu struktur komórkowych – zarówno bezpośrednio, jak i pośrednio – przez indukowanie stresu oksydacyjnego i zjawiska gliko- oraz lipoksydacji (Sartore i wsp., 2013). Stwierdzono, że produkcja reaktywnych form tlenu (ang. reactive oxygen species – ROS) jest zwiększona zarówno w skórze fotostarzejącej się w wyniku nadmiernej ekspozycji na promieniowanie ultrafioletowe (UV), jak i chronologicznie starzejącej się (Callaghan i wsp., 2008).
Przyjmijmy na moment bardziej redukcjonistyczne podejście i skoncentrujmy się tylko na jednej tkance: skórze. Pierwsze produkty glikacji kolagenu są obecne w skórze już około 20. roku życia. Badania naukowe wskazują też, że procesy glikacji w skórze ulegają istotnemu zwiększeniu ok. 35. roku życia i są istotną przyczyną starzenia wewnątrzpochodnego (endogennego), które wynika z predyspozycji genetycznych i zmian hormonalnych.
Z perspektywy klinicznej, zmiany glikacyjne nasilają się dramatycznie w cukrzycy, a efekt ten jest często określany jako „przyspieszone starzenie” („accelerated aging”) lub jako związane z wiekiem „brązowienie” ludzkiego kolagenu w cukrzycy. Wykazano również, że cząsteczki AGE, które oddziałują ze specyficznym receptorem transbłonowym, tj. receptorem AGE (RAGE), wpływają na progresję nowotworów. Z metabolicznego punktu widzenia, AGE-RAGE to bardzo niebezpieczne połączenie. Jakieś dowody? Wiele badań naukowych potwierdziło, że biologicznie stary kolagen typu I ma zdolność zwiększania proliferacji, a więc namnażania, ludzkich komórek nowotworowych (Bartling i wsp., 2009; Damodarasamy i wsp., 2015; Saby i wsp., 2016). Tę zależność można wyrazić za pomocą następującego równania
NISKA JAKOŚĆ KOLAGENU = ZWIĘKSZONE RYZYKO RAKA
AGEs a starzenie szczurów
Znaczenie AGEs zostało zademonstrowane w badaniach na modelu zwierzęcym, gdy normalnym szczurom podano mieszaninę AGEs przygotowanych in vitro (łac. „w szkle”). Badacze później zaobserwowali, że u gryzoni wystąpiły typowe zmiany związane z wiekiem, jak pogrubienie błony podstawnej czy usztywnienie aorty, przy braku hiperglikemii (podwyższone stężenie glukozy w surowicy krwi).
Ciemne plamy na skórze jako objaw starzenia biologicznego
Chyba każdy z nas w swoim życiu spotkał osobę/-y w starszym wieku, u których były widoczne ciemne plamy na skórze dłoni, szyi albo twarzy. Są to tzw. plamy starcze, a de facto złogi lipofuscyny (wewnątrzkomórkowy barwnik) w komórkach skóry, które powstają w wyniku utleniania (oksydacji) białek i lipidów w procesach komórkowych. W medycynie plamy starcze nazywane są plamami soczewicowatymi starczymi (łac. lentigo senilis; LS), które potocznie są nazywane błędnie plamami wątrobowymi.

Te żółto-brązowe pigmenty i produkty fluorescencyjne gromadzą się w tkankach ze stosunkowo długim okresem półtrwania (Monnier i wsp., 1984). Szczególnie dotyczy to kluczowego białka macierzy zewnątrzkomórkowej (ang. extracellular matrix – ECM) – kolagenu typu I, który wydaje się być preferencyjnym celem modyfikacji podczas chronologicznego i patologicznego starzenia się (Bailey i wsp., 1998). Proces ten jest częściowo spowodowany przez reakcję Maillarda, która jest nieenzymatyczną (i nieodwracalną!) reakcją pomiędzy cukrami redukującymi (jak np. glukoza, maltoza czy ryboza) a wolnymi grupami aminowymi białek:
- grupy α-aminowe (jak w przypadku waliny obecnej w hemoglobinie);
- grupy ε-aminowe (jak w przypadku lizyny związanej z peptydami).
W skrócie: są to szkodliwe interakcje między cukrami a różnego typu białkami. Co gorsze, te „zmutowane” kompleksy mogą następnie zostać utlenione do jeszcze bardziej reaktywnych związków.
A propos hemoglobiny: w ramach badań laboratoryjnych można oznaczyć hemoglobinę glikowaną (HbA1c), która jest klasycznym przykładem AGE i pośrednim biomarkerem starzenia biologicznego.

Inne czynniki glikacji mogą pochodzić z utleniania lipidów (tłuszczów), takie jak dialdehyd malonowy (powstający np. w wyniku promieniowania UV) lub metabolit metyloglioksal (ang. methylglyoxal – MGO; duża ilość tego związku występuje w szeroko polecanym miodzie Manuka), z których oba, choć występują w niewielkich ilościach, reagują bardzo szybko z łańcuchami bocznymi lizyny i argininy. Tworzą się wtedy związki lipotoksyczne (ang. advanced lipoxidation end-products – ALE).
Ciekawostka: obecności AGEs w skórze sprzyja brak ochrony przeciwsłonecznej, co oznacza, że promieniowanie ultrafioletowe (szczególnie UVA) sprzyja glikacji, a w konsekwencji glikacja promuje fotostarzenie skóry.
Graficzne ujęcie postępującej wraz z wiekiem degradacji struktury kolagenu i innych elementów tkanek miękkich (na przykładzie skóry) przedstawia rysunek poniżej.
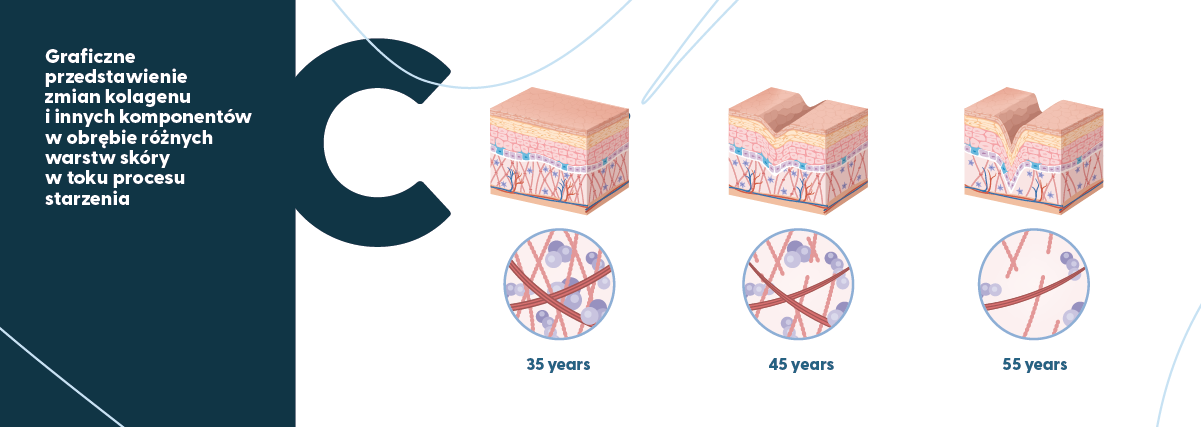
W warunkach fizjologicznych kolagen typu I w tkankach miękkich wykazuje szybszy obrót niż w kościach (Gineyts i wsp., 2000).
Jak już wiemy, AGEs mogą bardzo negatywnie wpływać na elastyczność tkanki kolagenowej i ich strukturę molekularną (Fessel i wsp., 2014). Modelowym „czarnym charakterem” w tym zjawisku są monosacharydy (jednocukry, jak np. glukoza czy fruktoza) w wysokich stężeniach molowych, znane z bezpośredniego, negatywnego wpływu na strukturę i stabilność włókien kolagenowych (Gautieri i wsp., 2017). Nasze kubki smakowe i mózg uwielbiają słodycze i wszelkie wyroby cukiernicze, ale kolagen niestety ich nie znosi 😉
Tworzenie AGEs jest zarówno spontaniczne, jak i dość powolne, dotyczy tylko białek o stosunkowo długim okresie półtrwania i które zawierają łańcuchy boczne lizyny i argininy (Ansari i Dash, 2013; Dyer i wsp., 1993; Sensi i wsp., 1995; Yamagishi, 2011). Z tych względów, białka o budowie włóknistej, które pełnią funkcje podporowe, inaczej białka fibrylarne (do tej grupy białek należy kolagen, ale również keratyna, miozyna i fibroina) są bardzo podatne na proces glikacji. Oczywiście zakres zmian związanych z wiekiem, np. tworzenia glikacyjnych wiązań krzyżowych, zależy od tempa obrotu danej tkanki kolagenowej. Białka kolagenu są uznawane za długożyjące i chociaż okres półtrwania kolagenu różni się istotnie w poszczególnych tkankach, to generalnie pozostaje on względnie długi, wahając się od 1 do 2 lat dla kolagenu typu I w kościach, do 10–15 lat w skórze właściwej i ponad 100 lat dla kolagenu typu II w chrząstce stawowej (Avery i Bailey, 2006; Verzijl i wsp., 2000; Toyama i Hetzer, 2013). Wynika z tego, że spośród różnych tkanek/struktur naszego organizmu, zakres glikacji jest zdecydowanie największy w chrząstce stawowej (Bailey, 2002). Dlatego tak wiele osób cierpi współcześnie na chorobę zwyrodnieniową stawów, która jest konsekwencją m. in. degeneracji kolagenu typu II
Czy kolagen świeci (fluoryzuje)?
Obecnie główną metodą do znakowania kolagenów w żywych tkankach jest autofluorescencja. Metoda ta jest niespecyficzna i wymaga kosztownej aparatury, ale pozwala na uzyskanie wybiórczej fluorescencji struktur zawierających kolagen, zarówno w tkankach żywych, jak i utrwalonych. A teraz uwaga! Cechą charakterystyczną AGEs jest specyficzna fluorescencja, wynikająca z połączenia pomiędzy cukrami a lizyną występującą w białkach. Na tej podstawie wiemy, że kolagen uszkodzony przez cząsteczki AGE świeci (fluoryzuje). Istnieją w tym zakresie bardzo ciekawe dane naukowe. Już na początku lat 90-tych XX wieku Odetti i wsp. (1992) zaobserwowali wykładniczy (geometryczny) wzrost intensywności fluorescencji związanej z kolagenem wraz z wiekiem u ludzi. Trend ten sugeruje, że AGEs gromadzą się w tkankach łącznych, a więc bogatych w kolagen, w stałym tempie względnym. Badacze zdefiniowali względne tempo akumulacji jako wielkość (l/y)(dy/dt), gdzie y to intensywność fluorescencji, a t to wiek. Zgodnie ze skomplikowanymi wyliczeniami, względne tempo akumulacji AGEs w kolagenie wynosi około… 3,7% na rok. Interesujące jest to, że przewidywana wartość osiągnięta po 100 latach, z powodu wykładniczego tempa wzrostu, odpowiada wzrostowi o 3000% w ciągu całego życia! Oznacza to, że w miarę postępu procesu starzenia biologicznego, coraz większy procent całkowitej puli kolagenu jest uszkodzony, m. in. z powodu patologicznych zmian wywołanych akumulacją AGEs. Z tych względów, współczesny człowiek żyjący zgodnie z zachodnim modelem życia znajduje się między młotem a kowadłem, bo z jednej strony piekielnie niebezpieczne cząsteczki AGE kumulują się w kolagenie w sposób wykładniczy, a z drugiej strony endogenna (wewnętrzna) synteza kolagenu nieustannie się obniża wraz z wiekiem.
Na podstawie specyfiki powyższego trendu i wysokiej powtarzalności danych dotyczących fluorescencji zarówno u zwierząt, jak i u ludzi, sugeruje się, że intensywność fluorescencji związanej z kolagenem może być wykorzystana jako biologiczny marker starzenia się u ssaków.
Kolagenowy zegar starzenia biologicznego
Ponure, ale istotne informacje dotyczące losów kolagenu w organizmie w toku starzenia biologicznego przedstawiają się następująco:
- w wieku 20 lat organizm wymienia ok. 3 kg kolagenu rocznie;
- od około 25. roku życia tempo syntezy kolagenu obniża się o ok. 1% rocznie;
- już po 30. roku życia spada liczba fibroblastów, co istotnie zmniejsza możliwości syntezy kolagenu przez organizm;
- około 50–60. roku życia tempo syntezy (anabolizm) kolagenu jest niższe niż tempo rozpadu (katabolizm);
- około 70. roku życia organizm praktycznie nie wytwarza już kolagenu.
Poza spadkiem produkcji kolagenu, również stosunek kolagenu typu I do typu III zmniejsza się stopniowo z wiekiem, co jest procesem negatywnym (Hou i wsp., 2012; Varani i wsp., 2006).
Czy mamy jakieś gotowe rozwiązania? A może suplementacja?
Współczesna dieta jest uboga w żywność pobudzającą produkcję endogennego kolagenu i elastyny. Aktualnie naukowcy zwracają coraz większą uwagę na hydrolizaty białkowe, w tym kolagenowe, jako potencjalne suplementy diety.

Jak już wspomniano, kolagen jest głównym białkiem strukturalnym różnych tkanek łącznych, takich jak skóra, kości, chrząstki i ścięgna, i jest szeroko stosowany w medycynie i przemyśle spożywczym. Peptydy kolagenowe (ang. collagen peptides – CPs) są produktem enzymolizy (rozkładu polimeru przez enzymy) kolagenu lub żelatyny i są wykorzystywane jako ważne składniki aktywne ze względu na ich różnorodną bioaktywność, wysoką biodostępność i dobrą biokompatybilność (Oesser i wsp., 1999; Zhuang i wsp., 2009; Zague, 2008). Badania naukowe potwierdziły istotne znaczenie hydrolizatów kolagenowych różnego pochodzenia (rybiego, wołowego i innych) w uzupełnianiu niedoborów kolagenu. W kontekście hamowania procesu starzenia biologicznego zaobserwowano, że CPs wpływają na regulację aktywności enzymów antyoksydacyjnych, a więc działają przeciwutleniająco i przeciwzapalnie (Maltese i wsp., 2017). W innych badaniach wykazano, że dipeptyd w postaci Pro-Hyp (połączenie aminokwasów proliny i hydroksyproliny) we krwi ludzkiej po doustnym spożyciu CPs stymuluje wzrost fibroblastów, co stanowi czysty efekt „anti-aging” (Ohara i wsp., 2010).
Gdy np. boli kolano: Choroby zwyrodnieniowe są istną plagą wśród ludzi w zaawansowanym wieku. Uważa się, że hydrolizaty kolagenu mogą przyczyniać się do odbudowy chrząstki stawowej w chorobach zwyrodnieniowych, ale również w stanach zapalnych kości i stawów.
Dawkowanie kolagenu powinno być maksymalnie zindywidualizowane. Jednak z powodu chronicznej ekspozycji ludzi na wiele czynników ryzyka zdrowotnego, zalecana dawka kolagenu wynosi nawet 10 g dziennie (szeroki zakres to 2,5–10 g). W badaniach klinicznych u osób dorosłych stosowano zazwyczaj dzienną dawkę 2,5 g lub 5 g CPs (Proksch i wsp., 2014; Schwartz i wsp., 2012; Ohara i wsp., 2009). Jedna buteleczka suplementu firmy „Collibre” („koliberek”) o pojemności 140 ml zawiera 10000 mg, czyli 10 g wysoko przyswajalnego kolagenu. Suplementację powinno się stosować regularnie przez okres minimum 3 miesięcy, a optymalnie w sposób długookresowy (przewlekle). Warto mieć w pamięci podstawową zasadę: im ktoś jest starszy, tym większe zapotrzebowanie organizmu na egzogenny, a więc podawany wraz z dietą/suplementem kolagen. Jednak im wcześniej zaczniemy suplementację, tym lepiej. Pierwsze efekty suplementacji ujawniają się zazwyczaj nie wcześniej niż po 2–3 miesiącach suplementacji. Na przykład efekty dotyczące redukcji dolegliwości bólowych w aparacie ruchu (zmora osób starszych) wymagają wielomiesięcznej suplementacji.
Istotna uwaga dotycząca jakości produktu
Kolagen powinien być dobrze zhydrolizowany (pocięty, w celu uzyskania niskiej masy cząsteczkowej). Szwajcarski kolagen oferowany przez firmę „Collibre” jest pochodzenia wołowego i jest bardzo dobrze zhydrolizowany (<2000 Da). Wcześniejsze badania naukowe wykorzystujące peptydy kolagenowe (CPs) z kości wołowej koncentrowały się głównie na jego korzystnym wpływie na metabolizm kości. Jednak w kolejnych badaniach stwierdzono, że CPs z kości wołowej miały również korzystny wpływ na stan skóry (Song i wsp., 2017). Peptydy kolagenowe wykorzystane w tym badaniu składały się głównie z oligopeptydów (<1000 Da). Stwierdzono, że małe peptydy, zwłaszcza di- i tripeptydy, są łatwiej wchłaniane w przewodzie pokarmowym (jelicie cienkim) niż większe cząsteczki, a oligopeptydy są bardziej bioaktywne niż białka, polipeptydy i wolne aminokwasy (Bouglé i wsp., 2017; Jia i wsp., 2010). Dlatego mikroskopijne peptydy zawarte w „koliberku” są łatwo wchłaniane (przyswajalność wynosi 95%) i mogą wykazywać potencjalnie korzystne efekty biologiczne.
Reasumując, zamiast pić alkohol etylowy i w ramach toastu życzyć sobie nawzajem zdrowia,
lepiej pić kolagen firmy „Collibre” a zdrowie pojawi się bez potrzeby życzeń!
Piśmiennictwo
[1] Alt N, Carson JA, Alderson NL, Wang Y, Nagai R, Henle T, Thorpe SR, Baynes JW. Chemical modification of muscle protein in diabetes. Arch Biochem Biophys 2004, 425, 200-206.
[2] Ansari N.A., Dash D., Amadori glycated proteins: role in production of autoantibodies in diabetes mellitus and effect of inhibitors on non-enzymatic glycation, Aging Dis 2013, 4(1), 50-56.
[3] Avery N.C., Bailey A.J., The effects of the Maillard reaction on the physical properties and cell interactions of collagen, Pathol Biol 54(7) (2006) 387-95.
[4] Bailey A.J. Molecular mechanisms of ageing in connective tissues. Mechanisms of Ageing and Development, 2001, 122(7), 735-755.
[5] Bailey AJ, Paul RG, Knott L. Mechanisms of maturation and ageing of collagen. Mech Ageing Dev. 1998;106:1–56.
[6] Bailey, A.J. Changes in bone collagen with age and disease. Journal of Musculoskeletal and Neuronal Interactions, 2002, 2(6), 529-531.
[7] Bartling B, Desole M, Rohrbach S, Silber RE, Simm A. Age-associated changes of extracellular matrix collagen impair lung cancer cell migration. FASEB J, 2009, 23, 1510-1520.
[8] Bouglé, D., Bouhallab, S. Dietary bioactive peptides: Human studies. Crit. Rev. Food Sci. Nutr 2017, 57, 335-343.
[9] Brown SM, Smith DM, Alt N, Thorpe SR, Baynes JW. Tissue-specific variation in glycation of proteins in diabetes: evidence for a functional role of amadoriase enzymes. Ann NY Acad Sci 2005, 1043, 817-823,.
[10] Callaghan, T.M.; Wilhelm, K.P. A review of ageing and an examination of clinical methods in the assessment of ageing skin. Part I: Cellular and molecular perspectives of skin ageing. Int. J. Cosmet. Sci. 2008, 30, 313-322.
[11] Damodarasamy M, Vernon RB, Chan CK, Plymate SR, Wight TN, Reed MJ. Hyaluronan in aged collagen matrix increases prostate epithelial cell proliferation. In Vitro Cell Dev Biol Anim, 2015, 51, 50-58.
[12] Davis, N.R., Risen, O.M., Pringle, G.A. Stable, nonreducible cross-links of mature collagen. Biochemistry, 1975, 14, 2031-2036.
[13] Dyer D.G., Dunn J.A., Thorpe S.R., Bailie K.E., Lyons T.J., McCance D.R., Baynes J.W., Accumulation of Maillard reaction products in skin collagen in diabetes and aging, J Clin Invest, 1993, 91(6), 2463-2469.
[14] Fessel G., Y.F. Li, V. Diederich, M. Guizar-Sicairos, P. Schneider, D.R. Sell, V.M. Monnier, J.G. Snedeker, Advanced Glycation End-Products Reduce Collagen Molecular Sliding to Affect Collagen Fibril Damage Mechanisms but Not Stiffness, Plos One, 2014, 9(11).
[15] Gautieri, A., Passini, F.S., Silván, U., Guizar-Sicairos, M., Carimati, G., Volpi, P., Morettif M., Redaellic A., Berlia M., Snedeker, J.G. Advanced glycation end-products: Mechanics of aged collagen from molecule to tissue. Matrix Biology, 2017, 59, 95-108.
[16] Gineyts E., Cloos P.A. Borel O. Grimaud L., Delmas P.D., Garnero P. Racemization and isomerization of type I collagen C-telopeptides in human bone and soft tissues: assessment of tissue turnover. Biochem. J. 2000; 345: 481-485.
[17] Hamlin, C.R., Kohn, R.R. Determination of human chronological age by study of a collagen sample. Exp. Gerontol, 1972, 7, 377-379.
[18] Haus, J. M., Carrithers, J. A., Trappe, S. W., Trappe, T. A. Collagen, cross-linking, and advanced glycation end products in aging human skeletal muscle. Journal of applied physiology, 2007; 103(6), 2068-2076.
[19] Hou, H.; Li, B.; Zhang, Z.; Xue, C.; Yu, G.; Wang, J.; Bao, Y.; Bu, L.; Sun, J.; Peng, Z. Moisture absorption and retention properties, and activity in alleviating skin photodamage of collagen polypeptide from marine fish skin. Food Chem. 2012, 135, 1432–1439.
[20] Jia, J.; Zhou, Y.; Lu, J.; Chen, A.; Li, Y.; Zheng, G. Enzymatic hydrolysis of Alaska pollack (Theragra chalcogramma) skin and antioxidant activity of the resulting hydrolysate. J. Sci. Food Agric. 2010, 90, 635–640.
[21] Monnier VM, Kohn RR, Cerami A: Accelerated age-related browning of collagen in diabetes mellitus. Proc Natl Acad Sci USA, 1984, 81:583-587,.
[22] Monnier VM, Mustata GT, Biemel KL, Reihl O, Lederer MO, Zhenyu D, Sell DR. Cross-linking of the extracellular matrix by the maillard reaction in aging and diabetes: an update on “a puzzle nearing resolution”. Ann. N. Y. Acad. Sci. 2005, 1043, 533–544.
[23] Monnier VM, Mustata GT, Biemel KL, Reihl O, Lederer MO, Zhenyu D, Sell DR. Cross-linking of the extracellular matrix by the maillard reaction in aging and diabetes: an update on “a puzzle nearing resolution”. Ann NY Acad Sci 2005, 1043: 533–544.
[24] Odetti, P. R., Borgoglio, A., & Rolandi, R. Age-related increase of collagen fluorescence in human subcutaneous tissue. Metabolism, 1992, 41(6), 655-658.
[25] Oesser, S.; Adam, M.; Babel, W.; Seifert, J. Oral administration of 14C labeled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL). J. Nutr. 1999, 129, 1891–1895.
[26] Ohara, H.; Ito, K.; Iida, H.; Matsumoto, H. Improvement in the moisture content of the stratum corneum following 4 weeks of collagen hydrolysate ingestion. Nippon Shokuhin Kogaku Kaishi 2009, 56, 137–145.
[27] Proksch, E.; Segger, D.; Degwert, J.; Schunck, M.; Zague, V.; Oesser, S. Oral supplementation of specific collagen peptides has beneficial effects on human skin physiology: A double-blind, placebo-controlled study. Skin Pharmacol. Physiol. 2014, 27, 47–55.
[28] Reddy GK. Cross-linking in collagen by nonenzymatic glycation increases the matrix stiffness in rabbit achilles tendon. Exp Diabesity Res 5: 143–153, 2004.
[29] Saito, M., & Marumo, K. Effects of collagen crosslinking on bone material properties in health and disease. Calcified tissue international, 2015, 97(3), 242-261.
[30] Sartore, G., Piarulli, F., Ragazzi, E., Burlina, S., Chilelli, N. C., Sarais, C., … & Lapolla, A. (2013). Subclinical diastolic dysfunction in type 2 diabetic patients with and without carotid atherosclerosis: relationship with glyco-oxidation, lipid-oxidation and antioxidant status. International journal of cardiology, 163(2), 201-205.
[31] Schwartz, S.R.; Park, J. Ingestion of BioCell Collagen®, a novel hydrolyzed chicken sternal cartilage extract; enhanced blood microcirculation and reduced facial aging signs. Clin. Interv. Aging 2012, 7, 267–273.
[32] Sensi M., Pricci F., Pugliese G., De Rossi M.G., Petrucci A.F., Cristina A., Morano S., Pozzessere G., Valle E., Andreani D., et al., Role of advanced glycation end-products (AGE) in late diabetic complications, Diabetes Res Clin Pract 28(1) (1995) 9-17.
[33] Snedeker J.G., Gautieri A. (2014) The role of collagen crosslinks in ageing and diabetes – the good, the bad, and th
[34] Song, H., Zhang, S., Zhang, L., & Li, B. (2017). Effect of orally administered collagen peptides from bovine bone on skin aging in chronologically aged mice. Nutrients, 9(11), 1209.
[35] Toyama B.H., Hetzer M.W., OPINION Protein homeostasis: live long, won’t prosper, Nat Rev Mol Cell Bio 14(1) (2013) 55-61.
[36] Vafaie, F., Yin, H., O’Neil, C., Nong, Z., Watson, A., Arpino, J. M., … & Pickering, J. G. (2014). Collagenase‐resistant collagen promotes mouse aging and vascular cell senescence. Aging Cell, 13(1), 121-130.
[37] Varani, J.; Dame, M.K.; Rittie, L.; Fligiel, S.E.; Kang, S.; Fisher, G.J.; Voorhees, J.J. Decreased collagen production in chronologically aged skin: Roles of age-dependent alteration in fibroblast function and defective mechanical stimulation. Am. J. Pathol. 2006, 168, 1861–1868.
[38] Vater CA, Harris ED Jr, Siegel RC (1979) Native cross-links in collagen fibrils induce resistance to human synovial collagenase. Biochem J. 181, 639–645.
[39] Verzijl N., DeGroot J., Thorpe S.R., Bank R.A., Shaw J.N., Lyons T.J., Bijlsma J.W.J., Lafeber F.P.J.G., Baynes J.W., TeKoppele J.M., Effect of collagen turnover on the accumulation of advanced glycation end products, Journal of Biological Chemistry 275(50) (2000) 39027-39031.
[40] Yamagishi, S. Role of advanced glycation end products (AGEs) and receptor for AGEs (RAGE) in vascular damage in diabetes, Exp Gerontol 46(4) (2011) 217-24.
[41] Zague, V. A new view concerning the effects of collagen hydrolysate intake on skin properties. Arch. Dermatol. Res. 2008, 300, 479–483.
[42] Zhuang, Y.; Hou, H.; Zhao, X.; Zhang, Z.; Li, B. Effects of collagen and collagen hydrolysate from jellyfish (Rhopilema esculentum) on mice skin photoaging induced by UV irradiation. J. Food Sci. 2009, 74, H183–H188.
Polecane wpisy na blogu:
Więcej artykułów

12 min. czytania
Kolagen: czym jest i na co pomaga?

7 min. czytania
Kolagen rybi czy wołowy: wszystko, co musisz wiedzieć

6 min. czytania








